Вещества, растворы которых полностью или частично состоят из ионов, называются электролитами. Распад молекул на ионы под действием молекул воды или другого растворителя называется электролитической диссоциацией.
Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации "α " и константой диссоциации Кд.
Степенью диссоциации называется отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Если из "с " молекул, находящихся в растворе, и х " молекул распалось на ионы, то степень диссоциации 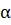 будет равна
будет равна 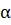 =
=  , или
, или 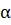 =
= 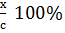 . Степень диссоциации зависит от температура, природы растворенного вещества и растворителя, концентрации раствора.
. Степень диссоциации зависит от температура, природы растворенного вещества и растворителя, концентрации раствора.
Процесс диссоциации является обратимым и приводит к состоянию равновесия, которое характеризуется константой равновесия. Процесс диссоциации вещества АВ выражается уравнением: 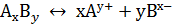
Константа равновесия равна 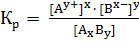 =
= 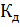
Постоянная 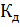 называется константой диссоциации. Она характеризует способность электролита диссоциировать на ионы. Чем больше
называется константой диссоциации. Она характеризует способность электролита диссоциировать на ионы. Чем больше 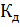 , тем больше ионов в растворе. Константа диссоциации не зависит от концентрации электролита, а зависит от природы электролита и от температуры.
, тем больше ионов в растворе. Константа диссоциации не зависит от концентрации электролита, а зависит от природы электролита и от температуры.
Закон разбавления Оствальда, связывающий три величины: 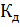 , с, α, выражается уравнением:
, с, α, выражается уравнением:
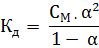
При малых значениях α разность 1- 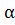 можно принять за единицу, тогда
можно принять за единицу, тогда
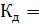
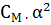 и
и 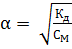 .
.
В результате диссоциации общее число частиц растворенного вещества в растворе увеличивается. Число, показывающее увеличение числа частиц в растворе, называется изотоническим коэффициентом Ванг-Гоффа и обозначается буквой i. Увеличение числа частиц вызывает изменение тех величин, которые зависят от числа частиц растворенного вещества в данном объеме раствора: 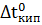 ,
, 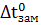 ,
, 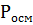 ,
, 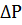 .
.
Если учесть изотонический коэффициент и определить истинное число частиц в растворе, то законы Рауля будут справедливы и для электролитов:
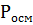 = i
= i 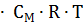 ;
;
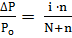 ;
;
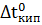 =
= 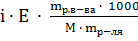 ;
;
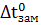 =
= 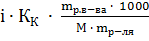 .
.
Степень электролитической диссоциации связана с изотоническим коэффициентом уравнением 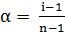 , где
, где 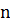 – число ионов, на которые распадается молекула электролита. Значения i позволяют определить степень диссоциации электролитов в растворах заданной концентрации.
– число ионов, на которые распадается молекула электролита. Значения i позволяют определить степень диссоциации электролитов в растворах заданной концентрации.
Пример 1. Вычисление кажущейся степени диссоциации сильного электролита.
Вычислить степень диссоциации 0.2 М раствора муравьиной кислоты НСООН, если 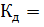 2.1
2.1 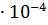 .
.
Но закону разбавления 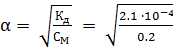 = 3.24
= 3.24 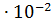 , или 3.24%.
, или 3.24%.
Пример 2. Вычисление степени диссоциации электролита по
осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации LiCl в
0.1 Н растворе соли, если раствор изотоничен с 0.19 М раствором сахара 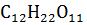 при 0°С.
при 0°С.
Решение. Моль сахара равен 342 г.
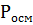 =
= 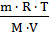 =
= 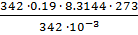 = 4.31
= 4.31 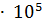 Па.
Па.
M(LiCI) = 42 г 
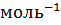 . По осмотическому давлению определяем изотонический коэффициент раствора LiCl:
. По осмотическому давлению определяем изотонический коэффициент раствора LiCl:
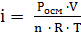 =
= 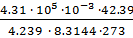 = 1.9.
= 1.9.
Кажущаяся степень диссоциации в 0.1 М LiCl равна
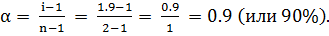
Пример 3. Вычисление степени диссоциации электролита по Понижению давления пара растворителя над раствором.
Давление пара водного раствора 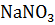 (
(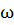 =0.08) равно 2268.8 Па при 20
=0.08) равно 2268.8 Па при 20 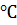 . Давление паров воды при этой температуре равно 2337.8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
. Давление паров воды при этой температуре равно 2337.8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
Решение. С помощью первого закона Рауля для электролитов вычисляем значение изотонического коэффициента для 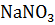 :
:
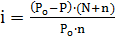 ;
;
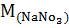 = 83.00 г
= 83.00 г 
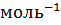 ; n = 8: 85.00 = 0.094 моль;
; n = 8: 85.00 = 0.094 моль;
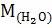 = 83.00 г
= 83.00 г 
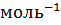 ; N = 92: 18.02 = 5.105 моль;
; N = 92: 18.02 = 5.105 моль;
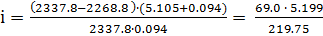 = 1.63.
= 1.63.
Кажущаяся степень диссоциации 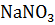 в этом растворе равна
в этом растворе равна
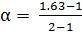 = 0.63 (или 63%).
= 0.63 (или 63%).
Пример 4. Вычисление изотонического коэффициента по повышению температуры кипения раствора.
Раствор, содержащий 8 г NaOH в 1000 г 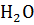 , кипит при 100.184 °С. Определите изотонический коэффициент (для воды Е=0.516 °С).
, кипит при 100.184 °С. Определите изотонический коэффициент (для воды Е=0.516 °С).
Решение. Второй закон Рауля для растворов электролитов выражается уравнением:
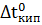 =
= 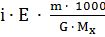
Тогда 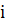 =
= 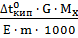 =
= 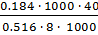 = 1.78.
= 1.78.
 2015-01-13
2015-01-13 10787
10787








