Электростатическое взаимодействие полярных молекул воды приводит к их самоионизации: 2 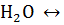
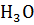 + +
+ + 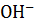 или в упрощенной форме
или в упрощенной форме 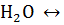
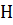 + +
+ + 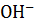 ;
;
Константа диссоциации воды весьма мала:
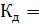
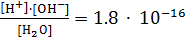 при 25 °С.
при 25 °С.
Принимая поэтому концентрацию воды 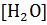 величиной практически постоянной, можно записать
величиной практически постоянной, можно записать
Кд 
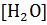 =
= 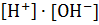 =
= 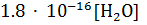 .
.
Но концентрация воды равна 1000 / 18 = 55.56 моль 
 , отсюда получаем
, отсюда получаем 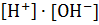 =
= 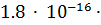 55.56 =
55.56 = 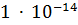 =
= 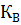 .
.
Произведение концентраций ионов водорода и ионов гидроксида называется ионным произведением воды ( 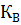 ). Ионное произведение воды есть величина постоянная при постоянной температуре.
). Ионное произведение воды есть величина постоянная при постоянной температуре.
В чистой воде и нейтральных растворах
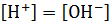 =
= 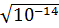 =
= 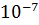 моль
моль 
 .
.
Математически более удобной характеристикой среды является водородный показатель pH, равный десятичному логарифму концентрации водородных ионов, взятому с обратным знаком: pH = -lg 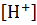 . Тогда pH различных растворов будут иметь следующие значения:
. Тогда pH различных растворов будут иметь следующие значения:
кислотный pH < 7.
нейтральный pH = 7,
щелочной pH > 7.
Аналогично, отрицательный десятичный логарифм концентрации гидроксо-ионов называется гидроксильным показателем и обозначается рОН.
Следовательно, 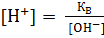 ;
; 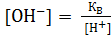 ; pH + рОН = 14.
; pH + рОН = 14.
Пример 1. Вычисление водородного показателя раствора.
Вычислите водородный показатель pH раствора гидроксида натрия, содержащегося в растворе в концентрации 4.2 
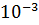 моль
моль 
 .
.
Решение. Концентрация 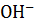 ионов в растворе NaOH равна:
ионов в растворе NaOH равна:
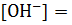 4.2
4.2 
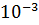 моль
моль 
 .
.
Исходя из ионного произведения воды Кв, находим концентрацию ионов водорода:
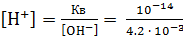 = 0.24
= 0.24 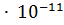 .
.
Водородный показатель раствора NaOH равен:
pH = - lg(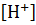 ) = - lg(0.24
) = - lg(0.24 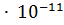 ) = 11.62.
) = 11.62.
Пример 2. Определение концентрации ионов 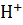 и
и 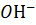 в растворах сильных кислот и оснований.
в растворах сильных кислот и оснований.
Определите концентрацию ионов водорода и pH в 0.01 М растворе соляной кислоты.
Решение. Соляная кислота - сильный электролит, в растворе полностью диссоциирует на ионы: НСl 
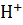 +
+ 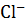 . Концентрация ионов
. Концентрация ионов 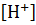 численно равна концентрации HCI. Из 0.01 моль HCI образуется 0.01 моль иона
численно равна концентрации HCI. Из 0.01 моль HCI образуется 0.01 моль иона 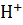 .
.
Отсюда, 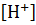 = 0.01 = 1
= 0.01 = 1 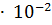 ; pH = -Ig
; pH = -Ig 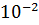 = 2.
= 2.
Пример 3. Вычисление pH сильного электролита с учетом его коэффициента активности.
Найдите водородный показатель раствора 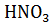 , если его молярная концентрация равна 0.178 моль
, если его молярная концентрация равна 0.178 моль 
 .
.
Решение. При значительной концентрации сильного электролита его активная концентрация существенно отличается от истинной. Поэтому в таких случаях нужно вводить поправку на активность электролита. Определяем ионную силу раствора 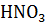 :
:
J = 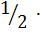 (0.178
(0.178 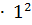 + 0.178
+ 0.178 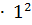 ) = 0.356/2 = 0.178.
) = 0.356/2 = 0.178.
Далее по вычисленной ионной силе находим коэффициент активности иона 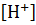 : f(
: f(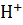 ) = 0.838. Тогда активность ионов
) = 0.838. Тогда активность ионов 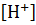 : a(
: a(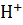 ) = 0.83
) = 0.83  0.178 = 0.148. Водородный показатель раствора
0.178 = 0.148. Водородный показатель раствора 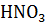 равен:
равен:
pH = -Ig а(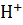 ) = -Ig 0.148 = 0.83.
) = -Ig 0.148 = 0.83.
Пример 4. Определение концентрации ионов 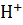 и
и 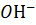 в растворах слабых кислот и оснований.
в растворах слабых кислот и оснований.
Концентрации 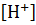 и
и 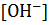 ионов в растворах слабой кислоты и слабого основания могут быть вычислены, если известны их константы диссоциации.
ионов в растворах слабой кислоты и слабого основания могут быть вычислены, если известны их константы диссоциации.
В общем виде формула для вычисления концентрации 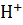 в растворе слабой кислоты:
в растворе слабой кислоты: 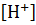 =
= 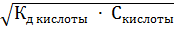 ;
;
Концентрация ионов 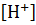 и
и 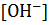 в растворе слабого основания может быть вычислена по формуле:
в растворе слабого основания может быть вычислена по формуле:
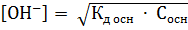 ;
; 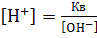 ;
; 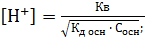 .
.
Определите концентрацию 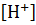 ,
, 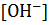 , pH и рОН в 0.03 М растворе муравьиной кислоты, если
, pH и рОН в 0.03 М растворе муравьиной кислоты, если 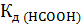 = 2.1
= 2.1 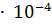 .
.
 2015-01-13
2015-01-13 2383
2383
