Направление и возможность протекания термодинамических процессов определяют с помощью второго начала термодинамики. Подобно тому, как первое начало термодинамики вводит функцию состояния – внутреннюю энергию, второе начало вводит функцию – энтропию S. Характер изменения энтропии позволяет разделить термодинамические процессы на два класса:
а) необратимые процессы, в ходе которых энтропия возрастает;
б) обратимые процессы, в ходе которых энтропия остается неизменной.
Процессы, способствующие дезагрегации, беспорядку, приводят к росту энтропии. Это процессы испарения, растворения, расширения газов, разрыв связей между атомами и т.п. Процессы, способствующие упорядочению системы (конденсация, кристаллизация, сжатие, полимеризация и т.д.) ведут к уменьшению энтропии. Энтропию рассматривают как меру неупорядоченности системы. Ее изменение определяется соотношением
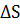 =R ln
=R ln 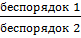 ,
,
где 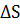 – изменение энтропии, Дж
– изменение энтропии, Дж 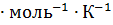 ;
;
R – газовая постоянная.
Энтропия является функцией состояния системы, и изменение энтропии рассматривают по формуле:
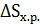 =
= 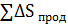 -
- 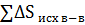
При нагревании системы изменение энтропии определяют по формуле
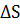 =
= 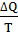
Изменение энтропии, связанное с фазовыми переходами (плавление, сублимация, испарение, энантиотропные превращения), можно вычислить из выражения:
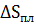 = ∆
= ∆ 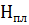 /
/ 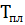
При рассмотрении процессов и реакций необходимо учитывать состояние веществ, участвующих в превращениях [1].
Энтропия является критерием направленности процесса в изолированной системе. Если 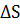 > 0, реакция идет в прямом направлении, если
> 0, реакция идет в прямом направлении, если 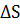 < 0 – самостоятельное протекание реакции невозможно.
< 0 – самостоятельное протекание реакции невозможно. 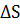 =0 – критерий равновесия системы.
=0 – критерий равновесия системы.
Пример 1. Определение изменения энтропии в стандартных условиях. Определить изменение энтропии реакции 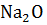 +
+ 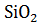 =
= 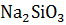 при температуре 298 К.
при температуре 298 К.
Решение. Находим по справочнику значения энтропии продукта и исходных веществ при Т=298 К
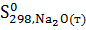 = 42, 09 Дж
= 42, 09 Дж 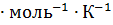
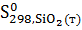 = 71, 1 Дж
= 71, 1 Дж 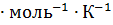
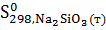 = 113, 8 Дж
= 113, 8 Дж 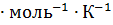
Изменение энтропии в химической реакции равно разности между суммой энтропий продуктов реакции и суммой энтропий исходных веществ с учетом стехиометрических коэффициентов.
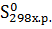 =
= 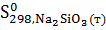 -
- 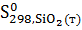 -
- 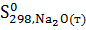 =
=
113,8-71,1-42,09=0,61 Дж 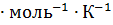
Пример 2. Определение изменения энтропии при фазовых превращениях.
Определить изменение энтропии 1г кристобалита при температуре плавления 1986 К, если теплота обратимого фазового превращения кристобалита равна 744,05 Дж 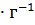
Решение. Изменение энтропии при переходе вещества из одного агрегатного состояния в другое равно:
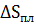 =
= 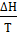 ,
,
где ∆ 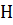 – теплота фазового превращения.
– теплота фазового превращения.
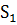 -
- 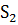 =
= 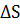 = ∆
= ∆ 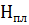 /
/ 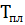 = 744,05 /1986 = 0,238 Дж
= 744,05 /1986 = 0,238 Дж 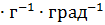
 2015-01-13
2015-01-13 3948
3948
