Гетерогенное равновесие “осадок  насыщенный раствор" подчиняется правилу произведения растворимости. Если малорастворимый электролит диссоциирует по уравнению
насыщенный раствор" подчиняется правилу произведения растворимости. Если малорастворимый электролит диссоциирует по уравнению 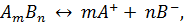 то выражение для произведения растворимости будет иметь вид:
то выражение для произведения растворимости будет иметь вид:
ПР(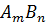 )
) 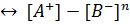
Отсюда вытекают два следствия:
1.Условие растворения осадка. Произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, должно быть меньше величины произведении растворимости;
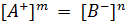 < ПР(
< ПР(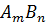 ).
).
2.Условие осаждения осадка. Произведение концентраций ионов, возведенных в степень их стехиометрических коэффициентов, должно был» больше величины произведения растворимости:
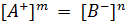 > ПР(
> ПР(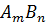 ).
).
Пример 1. Определение условий выпадения осадка.
Образуется ли осадок 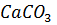 при смешивании равных объемов 0.02 М растворов хлористого кальция и углекислого натрия?
при смешивании равных объемов 0.02 М растворов хлористого кальция и углекислого натрия?
(ПР( ) = 1.0
) = 1.0 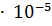 )
)
Решение. При смешивании равных объемов растворов 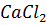 н
н 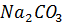 объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза.
объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза.
Следовательно,
[ 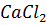 ] = [
] = [ 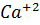 ] = 0.02
] = 0.02 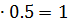
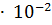 моль
моль 
 .
.
[ 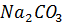 ] = [
] = [ 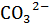 ] = 0.02
] = 0.02 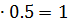
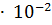 моль
моль 
 .
.
Откуда
[ 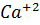 ]
]  [
[ 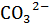 ] =
] = 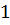
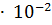
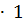
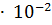 =
= 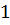
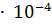 .
.
Осадок образуется, так как 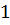
 <
< 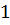
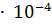 .
.
Пример 2. Вычисление концентрации ионов малорастворимого электролита в его насыщенном растворе.
Произведение растворимости 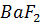 при 18
при 18 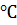 равно 1.7
равно 1.7  . Рассчитайте концентрацию ионов
. Рассчитайте концентрацию ионов 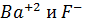 в насыщенном растворе
в насыщенном растворе 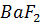 при этой температуре.
при этой температуре.
Решение. 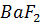 диссоциирует по уравнению
диссоциирует по уравнению 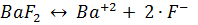
При диссоциации 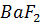 ионов
ионов 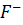 получается в 2 раза больше, чем ионов
получается в 2 раза больше, чем ионов 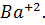 Следовательно, [
Следовательно, [ 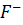 ] = 2
] = 2 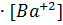 . Произведение растворимости соли ПР(
. Произведение растворимости соли ПР(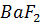 ) =[
) =[ 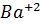 ]
] 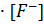 . Выразим концентрацию ионов
. Выразим концентрацию ионов 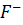 через концентрацию ионов [
через концентрацию ионов [ 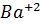 ], тогда
], тогда
ПР(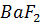 ) =[
) =[ 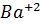 ]
] 
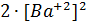 = 4
= 4 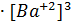 = 1.7
= 1.7  .
.
Концентрация ионов 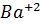 равна:
равна:
[ 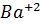 ] =
] = 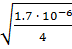 = 0.75
= 0.75 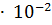 моль
моль 
 .
.
Концентрация ионов 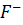 равна:
равна:
[ 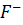 ] = 0.75
] = 0.75 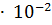
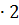 = 1.5
= 1.5 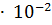 моль
моль 
 .
.
Пример 3. Вычисление произведения растворимости малорастворимого электролита.
Растворимость 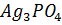 в воде при 20
в воде при 20 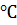 равна 0.0065 г
равна 0.0065 г 
 . Рассчитайте значение произведения растворимости.
. Рассчитайте значение произведения растворимости.
Решение. Растворимость 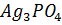 в моль
в моль 
 равна:
равна:
Р = 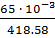 = 1.6
= 1.6 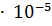 моль
моль 
 .
.
При диссоциации 1 моль 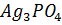 образуется 3 моль ионов
образуется 3 моль ионов 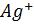 и 1 моль ионов
и 1 моль ионов  , поэтому концентрация иона
, поэтому концентрация иона  равна растворимости
равна растворимости 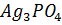 , а концентрация иона
, а концентрация иона 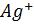 в 3 раза больше т.е.
в 3 раза больше т.е.
С[  ] = 1.6
] = 1.6 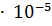 моль
моль 
 ; [
; [ 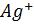 ] = 3
] = 3 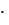 1.6
1.6 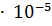 моль
моль 
 .
.
Произведение растворимости 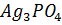 равно:
равно:
ПР = 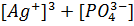 =
= 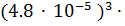 1.6
1.6 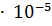 = 110.6
= 110.6  1.6
1.6 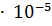 = 1.77
= 1.77 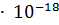 .
.
Пример 4. Определение условий одновременного выпадения осадков солей из раствора.
При каком соотношении концентрации ионов 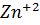 и
и 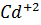 в растворе прибавление к нему раствора
в растворе прибавление к нему раствора 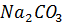 вызывает одновременное осаждение карбонатов этих ионов?
вызывает одновременное осаждение карбонатов этих ионов? 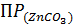 = 6
= 6 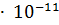 ,
, 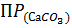 = 2.5
= 2.5 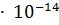 .
.
Решение. Концентрацию вводимых карбонат-ионов обозначим через [ 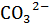 ], тогда:
], тогда:
[ 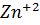 ] =
] = 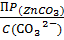 ; [
; [ 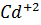 ] =
] =  ;
;
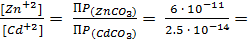 2.4
2.4  =2400.
=2400.
Карбонаты цинка и кадмия будут выпадать одновременно из раствора, если [ 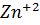 ] >
] > 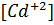 в 2400 раз. Если отношение [
в 2400 раз. Если отношение [ 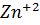 ] /
] / 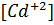 > 2400, то первым из раствора будет выпадать
> 2400, то первым из раствора будет выпадать 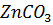 до тех пор, пока отношение [
до тех пор, пока отношение [ 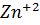 ] /
] / 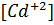 не будет равным 2400. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов цинка и кадмия меньше 2400, то первым начнет осаждаться карбонат кадмия. Осаждение карбоната кадмия будет протекать до тех пор, пока отношение [
не будет равным 2400. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов цинка и кадмия меньше 2400, то первым начнет осаждаться карбонат кадмия. Осаждение карбоната кадмия будет протекать до тех пор, пока отношение [ 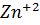 ] /
] / 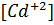 не достигнет значения, при котором
не достигнет значения, при котором 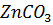 и
и 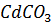 будут осаждаться одновременно.
будут осаждаться одновременно.
Пример 5. Вычисление растворимости электролита по величине произведения растворимости.
Произведение растворимости ПР оксалата бария 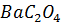 равно 1.62
равно 1.62 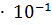 . Вычислите растворимость
. Вычислите растворимость 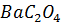 в воде.
в воде.
Решение. В растворе труднорастворимого сильного электролита 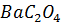 существует равновесие:
существует равновесие: 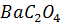 = Ва+2 + (
= Ва+2 + (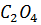 )2-
)2-
в осадке в растворе 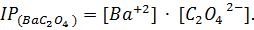
Так как оксалат бария диссоциирует на два иона, то концентрация его в раствора равна концентрации каждого из ионов, т.е.
[ 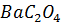 ]
] 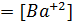 =
= 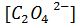 =
= 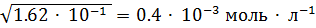 , т.е. растворимость оксалата бария в воде при 1° = 20 °С равна
, т.е. растворимость оксалата бария в воде при 1° = 20 °С равна 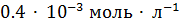 .
.
 2015-01-13
2015-01-13 1191
1191
