Свойство, которое характеризует работоспособность системы, называется энергией Гиббса или изобарно-изотермическим потенциалом и обозначается буквой G.
При любом процессе, протекающем самостоятельно при постоянных величинах давления и температуры, энергия Гиббса уменьшается, и величина G приобретает минимальное значение. Следовательно, условием протекания химической реакции является неравенство 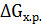 < 0; условием химического равновесия
< 0; условием химического равновесия 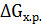 = 0. Если
= 0. Если 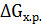 > 0, химическая реакция самопроизвольно протекать не может.
> 0, химическая реакция самопроизвольно протекать не может.
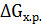 является функцией состояния, поэтому:
является функцией состояния, поэтому:
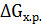 = ∑
= ∑ 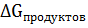 - ∑
- ∑ 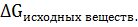
Изменение энергии Гиббса зависит от величины энтальпии, энтропии, температуры и определяется соотношением:
∆ 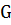 = ∆
= ∆ 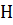 -T
-T 
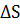
Самопроизвольно протекающие процессы идут в сторону уменьшения ∆ 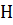 , увеличения
, увеличения 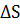 и температуры. Из соотношения видно, что самопроизвольно могут протекать процессы, для которых ∆
и температуры. Из соотношения видно, что самопроизвольно могут протекать процессы, для которых ∆ 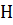 > 0 (эндотермические). Это возможно, если
> 0 (эндотермические). Это возможно, если 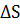 > 0, но [T
> 0, но [T 
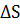 ] >[∆
] >[∆ 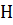 ], и тогда ∆
], и тогда ∆ 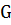 < 0. С другой стороны, экзотермические реакции ∆
< 0. С другой стороны, экзотермические реакции ∆ 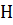 < 0 самопроизвольно не протекают, если при
< 0 самопроизвольно не протекают, если при 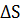 <0 окажется, что ∆
<0 окажется, что ∆ 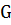 > 0.
> 0.
Пример 1. Вычисление уменьшения энергии Гиббса в химической реакции по значениям теплот образования и энтропий реагирующих веществ и продуктов реакции.
Вычислите 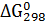 для химической реакции
для химической реакции
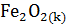 +
+ 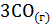 =
= 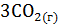 +
+ 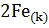
Возможно ли протекание этой реакции в стандартных условиях?
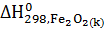 = -821,32 кДж
= -821,32 кДж 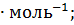
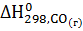 = -110,5 кДж
= -110,5 кДж 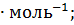
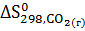 = -395,51 кДж
= -395,51 кДж 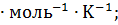
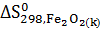 = 89,96 кДж
= 89,96 кДж 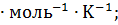
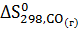 = 197,4 кДж
= 197,4 кДж 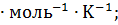
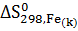 = 27,15 кДж
= 27,15 кДж 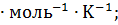
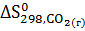 = 213,6 кДж
= 213,6 кДж 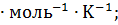
Решение. Изменение энергии Гиббса в химической реакции можно вычислить по уравнению: ∆ 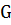 = ∆
= ∆ 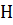 -T
-T 
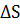 .
.
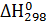 = 3
= 3 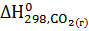 -
- 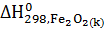 - 3
- 3 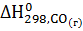 =
=
3(-393, 51) - (-821,32) -3(-110,5)= -27,71 кДж.
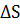 = 2
= 2 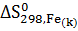 + 3
+ 3 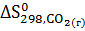 -
- 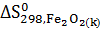 - 3
- 3 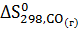 =
=
2  27,15 + 3
27,15 + 3 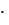 213,6 – 89,96 – 3
213,6 – 89,96 – 3  197,4 = 12,94 Дж
197,4 = 12,94 Дж 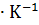
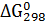 < 0, следовательно, в стандартных условиях протекание химической реакции возможно.
< 0, следовательно, в стандартных условиях протекание химической реакции возможно.
 2015-01-13
2015-01-13 1728
1728
