Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
Если реакция гетерогенная, то скорость измеряется количеством вещества системы, вступающего в реакцию или образующегося в результате реакции за единицу времени на единицу поверхности раздела фаз:
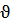 =
= 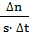 ,
,
где 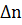 =
= 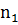 -
- 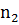 ,
, 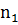 и
и 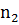 – количество реагирующего вещества в момент времени
– количество реагирующего вещества в момент времени 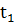 и
и 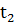 ;
; 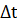 =
= 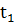 -
- 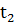 ;
; 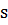 – площадь поверхности.
– площадь поверхности.
Скорость гомогенных реакций измеряется количеством вещества системы, вступающего в реакцию или образующегося в результате реакции за единицу времени на единицу объема:
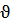 =
= 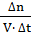 .
.
Так как 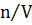 – молярная концентрация С, а
– молярная концентрация С, а 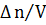 – ее изменение
– ее изменение  С, то средняя скорость v за отрезок времени
С, то средняя скорость v за отрезок времени 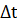 равна отношению
равна отношению 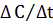 . Если
. Если 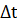 стремится к нулю, то в пределе средняя скорость
стремится к нулю, то в пределе средняя скорость 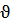 становится скоростью в данный момент времени или истинной скоростью
становится скоростью в данный момент времени или истинной скоростью 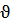 , которая равна производной от концентрации по времени:
, которая равна производной от концентрации по времени:
V = 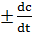 ,
,
Знак определяется направлением уменьшения концентрации вещества: плюс означает ее увеличение, а минус – уменьшение.
Скорость химической реакции зависит от:
1) природы реагирующих веществ; 2) условий, при которых протекает реакция, - концентраций реагирующих веществ, температуры, давления (для газов), облучение квантами света и др.,3) присутствия катализаторов.
Зависимость скорости реакции от концентрации определяется законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степени их стехиометричским коэффициентом.
Для реакции mA + nB = AmBn скорость химической реакции выражается равенством 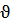 = k
= k 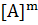

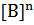 , где
, где 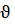 – скорость реакции, [A] и [B] – молярные концентрации реагирующих веществ, m, n – стехиометрические коэффициенты, k – константа скорости реакции, числено равная скорости реакции, когда произведение концентраций реагирующих веществ равно единице.
– скорость реакции, [A] и [B] – молярные концентрации реагирующих веществ, m, n – стехиометрические коэффициенты, k – константа скорости реакции, числено равная скорости реакции, когда произведение концентраций реагирующих веществ равно единице.
Закон действия масс применим только к гомогенным системам. В случае гетерогенных систем в выражение скорости реакции войдут лишь концентрации газообразных или растворенных веществ. Реакции с участием твердых тел протекают лишь по поверхности, концентрация твердого вещества остается постоянной и не входит в выражение скорости реакции.
Реакция в гомогенной системе:
2 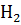 +
+ 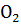 = 2
= 2 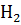 O
O
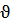 = k
= k 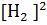
 [
[ 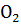 ]
]
Реакция в гетерогенной системе:
Ca 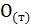 + C
+ C 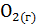 =
= 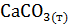
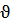 = k[
= k[ 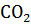 ]
]
Пример 1. Вычисление скорости реакции по концентрациям реагирующих веществ.
Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль 
 , а вещества В – 5 моль
, а вещества В – 5 моль 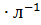 . Константа скорости реакции равна 0,5
. Константа скорости реакции равна 0,5 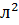

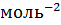

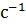 . Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной системе останется 45% вещества В.
. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной системе останется 45% вещества В.
Решение. Скорость химической реакции выражается уравнением:
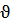 = k
= k 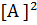
 [
[ 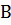 ].
].
Скорость химической реакции в начальный момент равна
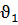 = 0,5
= 0,5 
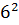
 5 = 90,0 моль
5 = 90,0 моль 
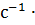
 . Через некоторое время в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет 5
. Через некоторое время в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет 5  0,45 = 2,25 моль
0,45 = 2,25 моль 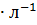 . Следовательно, концентрация вещества А уменьшилась на 5,5 моль
. Следовательно, концентрация вещества А уменьшилась на 5,5 моль 
 и стала равной 0,5 моль
и стала равной 0,5 моль 
 (6 - 5,5). Отсюда
(6 - 5,5). Отсюда
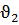 = 0,5
= 0,5 
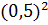
 2,25 = 0,28 моль
2,25 = 0,28 моль 
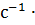
 .
.
Пример 2. Влияние давления на скорость реакции.
Определите, как изменится скорость прямой реакции 2СО + 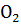 =
= 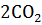 , если общее давление в системе увеличить в 4 раза.
, если общее давление в системе увеличить в 4 раза.
Решение. При увеличении давления в 4 раза объем системы уменьшится в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза.
Тогда 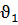 = k
= k 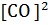
 [
[ 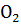 ], а
], а 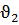 = k
= k 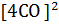
 [
[ 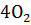 ].
].
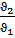 =
= 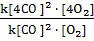 = 64
= 64
После увеличения давления в 4 раза скорость реакции возрастет в 64 раза.
 2015-01-13
2015-01-13 971
971








