Свойства ковалентной связи.1)ковалентная связь насыщенная, это значит что между атомами ограниченное число связей; 2)Связь направлена по оси ох, оу, оz; 3)Связь поляризуемая - деформируется во внешнем эл.поле.
Дипольный момент электрический, векторная величина, характеризующая асимметрию распределения положительных и отрицательных зарядов в электрически нейтральной системе. Два одинаковых по величине заряда +qи —q образуют электрический диполь с дипольный момент m = q l, где l - расстояние между зарядами. Для системы изn зарядов qi радиусы-векторы которых ri, 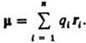 В молекулах и молекулярных системах центры положительных зарядов qА совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности r(r).
В молекулах и молекулярных системах центры положительных зарядов qА совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности r(r).
Электри́ческий ди́польный моме́нт — векторная физическая величина, характеризующая, наряду с суммарным зарядом (и реже используемыми высшими мультипольными моментами), электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей. Главная после суммарного заряда и положения системы в целом (ее радиус-вектора) характеристика конфигурации зарядов системы при наблюдении ее издали.
Простейшая система зарядов, имеющая определенный (не зависящий от выбора начала координат) ненулевой дипольный момент — это диполь (две точечные частицы с одинаковыми по величине разноимёнными зарядами). Электрический дипольный момент такой системы по модулю равен произведению величины положительного заряда на расстояние между зарядами и направлен от отрицательного заряда к положительному, или:
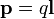
— где q — величина положительного заряда, 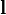 — вектор с началом в отрицательном заряде и концом в положительном.
— вектор с началом в отрицательном заряде и концом в положительном.
Для системы из N частиц электрический дипольный момент равен
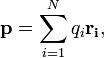
При соединении атомов, имеющих различные значения электроотрицательности, возникает ковалентная полярная связь. В этом случае общая электронная пара смещена в сторону ядра того атома, у которого электроотрицательность больше. Например, в молекуле хлористого водорода общая электронная пара смещена к ядру атома хлора, электронное облако неравномерно распределено в поле обоих ядер. В результате электрические центры положительных и отрицательных зарядов обоих атомов не совпадают в одной точке, что ведет к полярности связи.
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метана CH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
10. Ионная связь. Степень ионности. Зависимость между ионностью связи и положением элемента в периодической системе элементов Д.И.Менделеева. Свойства ионной связи.
Ионная связь- результат электростатического взаимодействия протонов, заряженных ионов обладающих обособленностью друг от друга электростатическими оболочками. Для оценки способности атома данного элем. оттягивать к себе общую эл. плотность пользуются величиной относительной электроотрицательности. Чем больше эл.отрицательность атома тем сильнее притягивает он общую эл. пару. Чем больше металлические свойства тем меньше эл.отрицательность. Чем больше неметаллические свойства тем выше эл.отрицательность. С ростом разности эл.отрицательности степень ионности связи возрастает. Достоинство и недостатки характеристики степени ионности. Если это ярко выраженные металлические или неметаллические, то можно определить где связь между атомами более полярна. Степень окисления - это тот заряд, который получил бы атом если эл. при образовании хим связи полностью переходили бы к более эл.отрицательному атому.
Степень ионности связи возрастает с увеличением разности электроотрицательности образующих ее атомов.
Таким образом, природа химической связи едина и существующее различие между видами связей имеет количественный характер.
Свойства ионной связи 1)Ионная связь ненаправленная так как эл.поле иона во всех направлениях; 2)Ионная связь ненасыщенная - вещества с ионной кристаллической решеткой – твёрдые.
 2015-01-13
2015-01-13 1393
1393
