Ковалентная связь- хим. связь между двумя атомами, осуществляемая общей для этих атомов парой электронов.а) ковалентная неполярная- неметалл + неметалл; разность электроотрицательностей = 0; б)ковалентная полярная - неметал+неметал разность электроотрицательностей от 0-1.7 Ковалентная хим.связь образуется двумя электронами, обладающими противоположно-направленными спинами и принадлежащими двум атомом, между которыми осуществляется связь. Такая общая электронная пара может образоваться как в результате спаривания двух не спаренных электронов, принадлежащих разным атомам (обычный механизм образования связи), так и за счёт пары эл. одного атома- донора и вакантной орбитали второго атома-акцептора (донорно-акцепторный механизм образования связи)
В основе метода валентных связей лежит следующие положения: 1)ковалентная хим.связь образуется двумя электронами, обладающими противоположно-направленными спинами и принадлежащими двум атомам, между которыми осуществляется связь. Такая общая электронная пара может образоваться как в результате спаривания двух не спаренных электронов, принадлежащих разным атомам (обычный механизм образования связи), так и за счёт пары эл. одного атома- донора и вакантной орбитали второго атома-акцептора (донорно-акцепторный механизм образования связи); 2)ковалентная связь тем прочнее чем в большей степени перекрываются взаимодействующие эл. облака, поэтому ковалентная связь образуется в том направлении, где облака перекрываются максимально.
|
|
|
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Валентность –это число хим. Связей, образованных данным атомом в соединении.
Основное состояние атома – состояние атома когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия в атоме является минимальной из возможных значений энергии. Состояния с более высокими значениями энергией называт возбужденными, а сам процесс или результат повышения энергии атома(или электрона) – возбуждением.
8. Ковалентная связь. Свойство ковалентной связи – направленность. σ- и π-связи. Одинарные и кратные связи. sp-, sp2-, sp3-гибридизация атомных орбиталей. Правило определения геометрической формы молекулы.
Ковалентная связь- хим. связь между двумя атомами, осуществляемая общей для этих атомов парой электронов.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется σ-связью.
|
|
|
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
Кратность. В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π-связью.
Кратность связи определяется количеством электронных пар, связывающих два атома, например:
этан H3C–CH3 одинарная связь (σ-связь)
этилен H2C=CH2 двойная связь (одна σ-связь и одна π-связь)
ацетилен HC≡CH тройная связь (одна σ-связь и две π-связи).
Кратные ковалентные связи
Атомы, имеющие более одного электрона на внешней оболочке, могут образовывать не одну, а несколько ковалентных связей между собой. Такие связи называются многократными (чаще кратными) связями. Примерами таких связей служат связи молекул азота (N=N) и кислорода (O = O).
Связь, образующаяся при объединении одинарных атомов называется гомоатомной ковалентной связью, если атомы разные, то связь называется гетероатомнной ковалентной связью [греческие префексы "гомо" и "гетеро" соответственно означают одинаковые и разные].
а) sp3-гибридизация. Одна S-орбиталь и три Р-орбитали превращаются в четыре одинаковые «гибридные» орбитали, ориентированные к вершинам тетраэдра, угол между осями 109,50(тетраэдрическая геометрия). б) sp2-гибридизация. Одна S и две P орбитали превращаются в три одинаковые орбитали, лежащие в одной плоскости. Угол между осями орбиталей равен 1200(плоская геометрия). в) sp- гибридизация одна S и одна P орбиталь превращаются в две одинаковые орбитали, угол между осями которых 1800(Линейная геометрия).
Геом форм молекулы
химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
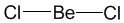
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о.
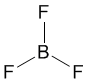
Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о:
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
|
|
|
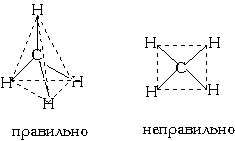
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’.
Последний пример: молекула H2O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.
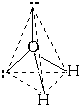
Реально этот тетраэдр слегка искажен, потому что неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реальный угол HOH составляет не 109о, а немногим менее 105о. Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму.
 2015-01-13
2015-01-13 2661
2661
