Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m(А) и m(В) пропорциональны их молярным массам эквивалентов (объемам):
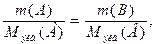 (1)
(1)
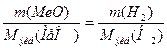 . (2)
. (2)
Если одно из веществ находится в газообразном состоянии, то его количество измеряется в объемных единицах (см3, л, м3, мл).
Объем, занимаемый при данных условиях молярной или молярной массой эквивалента газообразного вещества, называется молярным или соответственно эквивалентным объемом этого вещества. Молярный объем любого газа при н.у. равен 22,4 дм3. Отсюда эквивалентный объем водорода, молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 дм3. В формуле (2) отношение mН2/Мэкв(Н2)заменяем равным ему отношением VH2/Vэкв(H2), где VH2 – объем водорода,Vэкв(H2) - эквивалентный объем водорода:
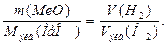 (3)
(3)
Из уравнения (3) находим молярную массу эквивалента оксида металла
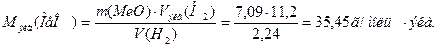
Согласно закону эквивалентов
Mэкв(MeO) = Mэкв(Me) + Mэкв(O), отсюда
Mэкв(Me) = Mэкв(MeO) – Mэкв(O) = 35,45 – 8 = 27,45 г/моль·экв.
Молярная масса металла определяется из соотношения
Мэкв(Ме) = М(Ме)/В, где Мэкв(Ме) – молярная масса эквивалента металла, М(Ме) – молярная масса металла, В – стехиометрическая валентность элемента; М(Ме) = Мэкв(Ме)∙В = 27,45·2 = 54,9 г/моль. Так как атомная масса в а.е.м. численно равна молярной массе, выражаемой в г/моль, то искомая масса металла 54,9 а.е.м.
Пример 3. Вычислить молярные массы эквивалентов Н2SO4 и Аl(ОН)3 в реакциях, выраженных уравнениями:
1) Н2SO4 + КОН = КНSO4 + Н2О,
2) Аl(OH)3 + HCl = Al(OH)2Cl + Н2О,
3) Аl(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
Решение.
Молярная масса эквивалента сложного вещества, так же как и молярная масса эквивалента элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество.
В реакции (1) в молекуле кислоты замещается 1 ион водорода, следовательно, fэкв(Н2SO4) = 1, поэтому Мэкв(Н2SO4) = М(Н2SO4) ∙1 = =98·1 = 98 г/моль∙экв.
В реакции (2) происходит замещение одной гидроксильной группы, поэтому fэкв(Аl(OH)3) =1, Мэкв(Аl(OH)3) = 78·1= 78 г/моль∙экв.
В реакции (3) происходит замещение трех гидроксильных групп, следовательно, fэкв(Аl(OH)3) =1/3, а Мэкв(Аl(OH)3) = 78·1/3 = 26 г/моль∙экв.
Пример 4. При восстановлении 1,6 г монооксида некоторого металла водородом образовалось 0,36 г воды. Определите молярную массу эквивалента металла и формулу оксида.
 2015-02-24
2015-02-24 813
813








