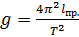 – формула ускорения свободного падения оборотного маятника.
– формула ускорения свободного падения оборотного маятника.
| № изм. | n | t(c) | t1(c) | T(с) | T1(c) | lпр.(м) | g(м/с) |
| 29,34 | 25,63 | 1,467 | 1,281 | 0,31 | |||
| 29,52 | 25,5 | 1,476 | 1,279 | 0,31 | |||
| 29,75 | 25,68 | 1,487 | 1,284 | 0,31 | |||
| 29,56 | 25,75 | 1,478 | 1,2875 | 0,31 | |||
| 29,50 | 25,74 | 1,475 | 1,287 | 0,31 | |||
| среднее | 29,53 | 25,61 | 1,4767 | 1,2838 | 0,31 | 5,61 |
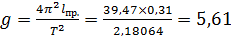 (м/с)
(м/с)
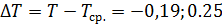 (c)
(c)
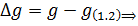
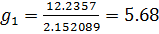 (м/с)
(м/с)
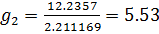 (м/с)
(м/с)
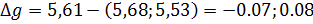
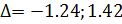 (%)
(%)
Вывод: На данной лабораторной работе я научился определять с помощью физического и математического ускорение свободного падения.
Ответы на контрольные вопросы:
1. Математический маятник — осциллятор, представляющий собой механическую систему, состоящую из материальной точки, находящейся на невесомой нерастяжимой нити или на невесомом стержне в однородном поле сил тяготения.
2. Физический маятник — осциллятор, представляющий собой твёрдое тело, совершающее колебания в поле каких-либо сил относительно точки, не являющейся центром масс этого тела, или неподвижной оси, перпендикулярной направлению действия сил и не проходящей через центр масс этого тела.
3. Приведенная длина физического маятника – это длина такого математического маятника, период колебаний которого совпадает с периодом данного физического маятника.
4. Теорема Штейнера: момент инерции J тела относительно произвольной неподвижной оси равен сумме момента инерции этого тела Jc относительно параллельной ей оси, проходящей через центр масс тела, и произведения массы тела m на квадрат расстояния d между осями.
5. Центр качаний, точка на перпендикуляре к оси подвеса, проходящем через центр массмаятника, которая расположена по ту же сторону от оси, что и центр масс, и отстоит от оси подвеса нарасстоянии приведённой длины физического маятника
6. Оборотный маятник - прибор для экспериментального определения ускорения свободного падения g. Представляет собой физический маятник.
7. 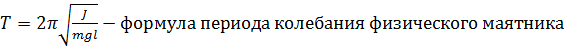 ;
;
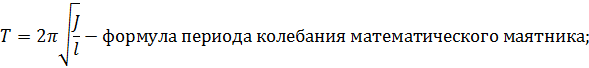
8. Когда маятник движется к положению равновесия вектора силы тяжести и углового ускорения направленны в точку равновесия, в случае когда маятник движется из положения равновесия вектор силы тяжести направлен в точку равновесия а вектор углового ускорения напротив, направлен от точки равновесия.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ФИЛИАЛ ФГБОУ ВПО «УГАТУ»
В Г. СТЕРЛИТАМАКЕ
КАФЕДРА ЕСТЕСТВЕННО-НАУЧНЫХ
И ОБЩЕПРОФЕССИОНАЛЬНЫХ ДИСЦИПЛИН
Отчет по лабораторной работе № 15
Изучение процесса кристаллизации.
Выполнил: Родионов В.В.
Проверила: Шишкина А.Ф.
Стерлитамак 2015г.
Тема: Изучение процесса кристаллизации
Цель работы:
Изучить процесс кристаллизации и формы растущих кристаллов при кристаллизации из растворов солей.
Приборы и принадлежности:
Биологический микроскоп, химические стаканы, электрическая плита, бюретки, медный купорос, поваренная соль.
Общая последовательность кристаллизации:
Переход вещества из жидкого в твердое (кристаллическое) состояние называется кристаллизацией. Процесс кристаллизации начинается при охлаждении расплавленного вещества до температуры ниже температуры кристаллизации. Кристаллизация протекает вследствие перехода системы в термодинамически устойчивое состояние, обладающее меньшей свободной энергией. Для начала процесса кристаллизации необходимо, чтобы свободная энергия твёрдой фазы была меньше чем свободная энергия жидкой фазы, это достигается при некотором переохлаждении сплава. Процесс кристаллизации происходит в две стадии: образование центров кристаллизации и роста кристаллов из них. С повышением переохлаждения возрастает разность свободных энергий жидкого и твердого состояний что способствует повышению скорости кристаллизации, т.е. увеличению числа зародышей. К росту способны лишь те кристаллы, рост которых сопровождается уменьшением свободной энергии системы. Такие зародыши называются критическими. Чем больше степень переохлаждения тем меньше размер критического зародыша. При небольшой степени переохлаждения (малой скорости их охлаждения) число зародышей мало, а скорость роста велика (получим крупное зерно). Рост кристаллов происходит в результате перехода к ним к ним атомов жидкости. При ускоренном охлаждении образуются дендритные (древовидные), пластинчатые или игольчатые кристаллы.
Рисунок 1 Этапы кристаллизации CuSO4
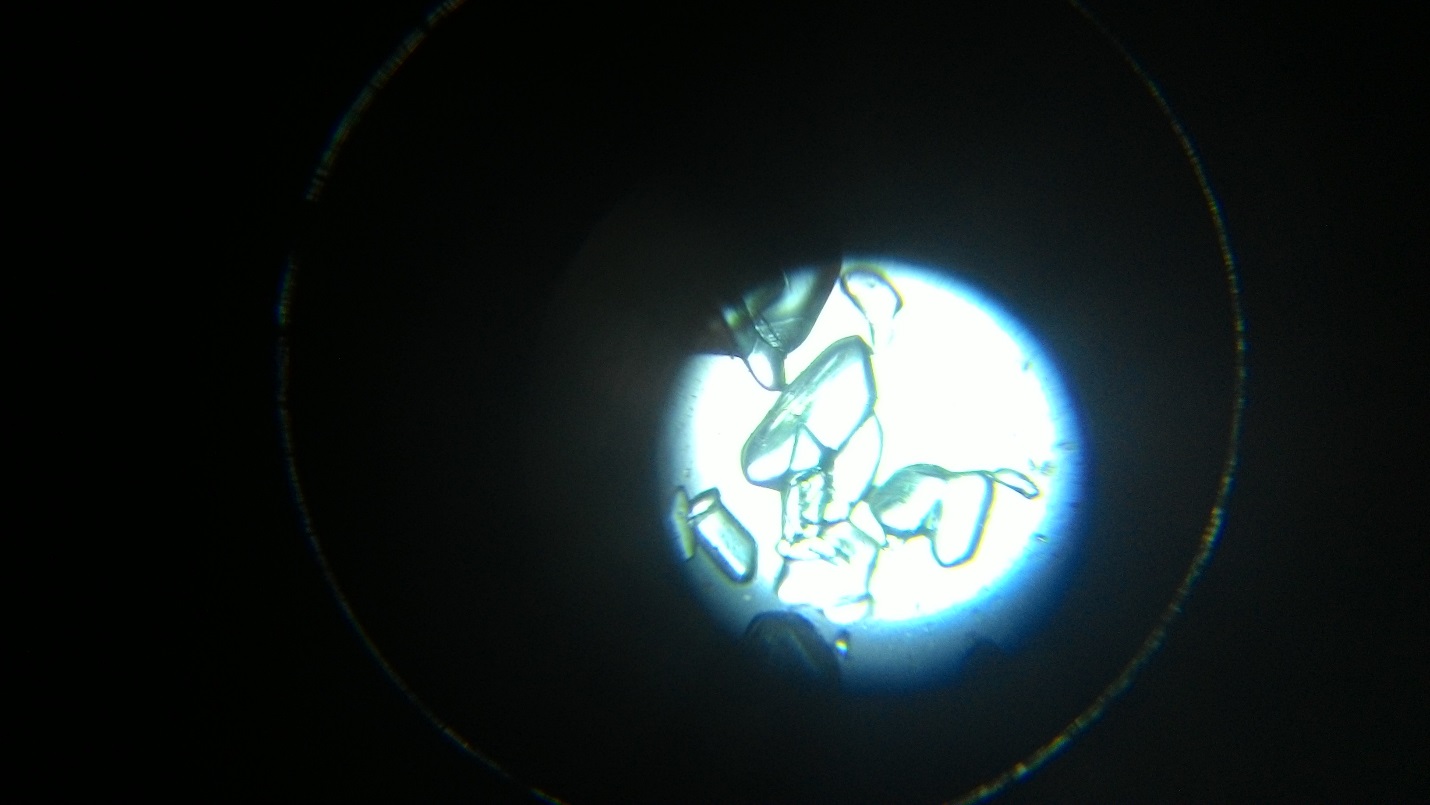
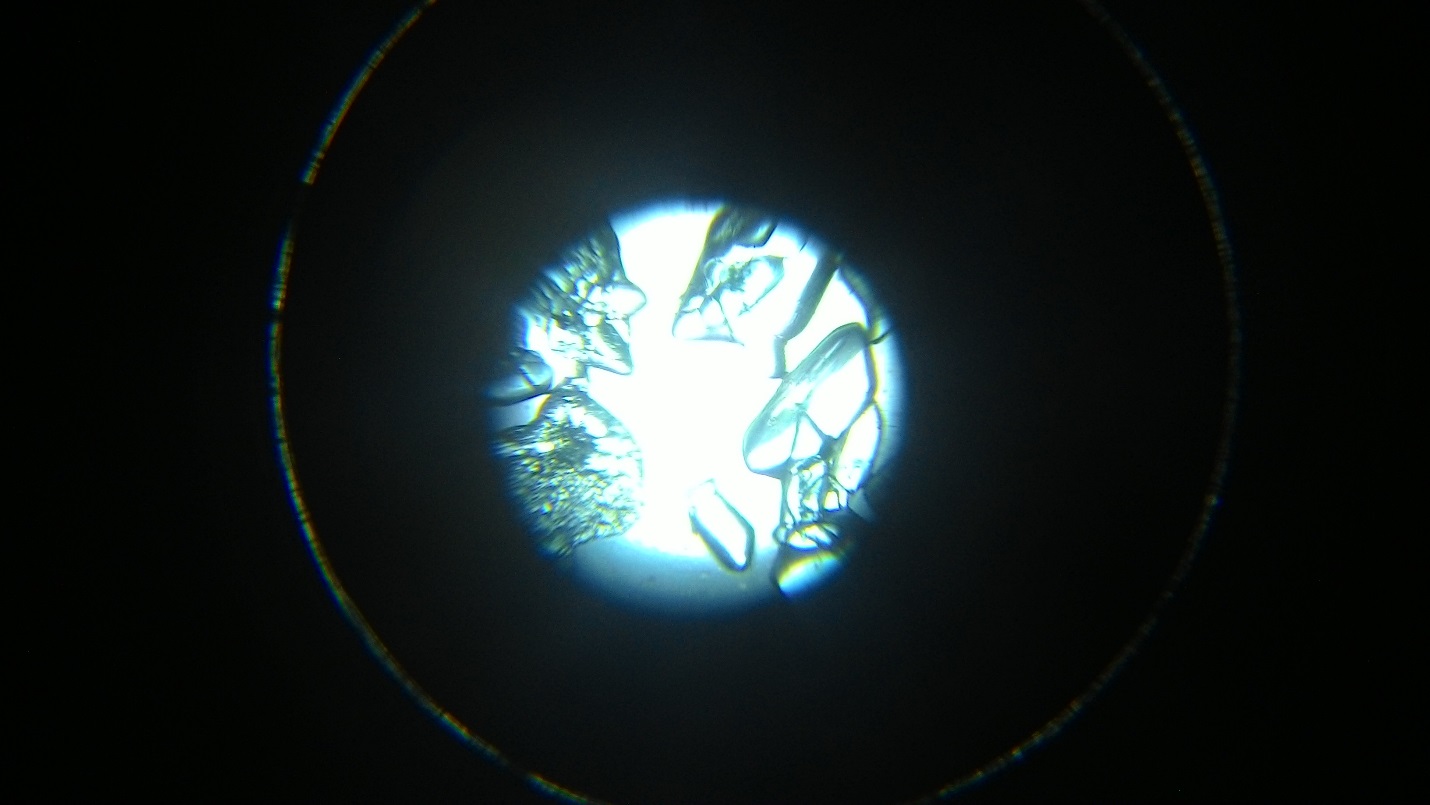
Рисунок 2 Этапы кристаллизации NaCl
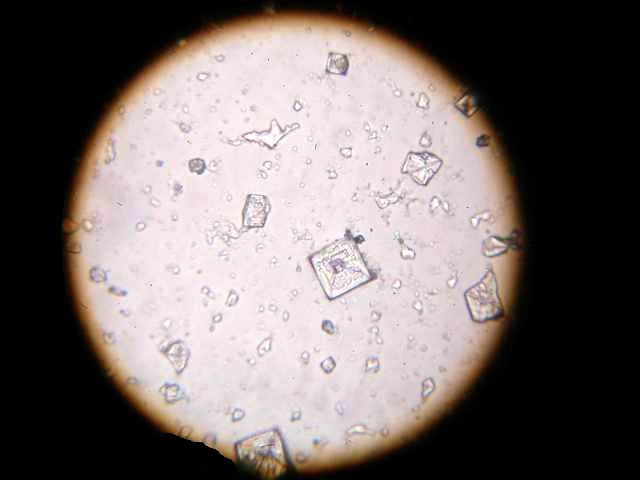
Кристаллизация CuSO4:
а) процесс кристаллизации начинается по краям капли, то есть там, где температура низкая
б) форма первых образовавшихся кристаллов является неправильной
в) процесс кристаллизации начинается с образования центров кристаллизации далее кристаллизация происходит в разные стороны от центров
г) форма кристаллов образовывающихся во вторую очередь также является неправильной как и в первом случае
д) процесс кристаллизации завершается в центре капли
е) в центре кристаллизации кристаллы имеют более правильную (вследствие приближения всей системы к равновесному состоянию), вытянутую(дендритную) форму из за ускоренного отвода тепла
ж) можно выделить зону кристаллизации по краям капли и зону кристаллизации вокруг центров кристаллизации, образующихся в центре капли
Кристаллизация NaCl:
а) процесс кристаллизации начинается по краям капли, то есть там, где температура низкая
б) форма первых образовавшихся кристаллов приближенно похожа на правильную
в) процесс кристаллизации начинается с образования центров кристаллизации далее кристаллизация происходит в разные стороны от центров
г) форма кристаллов образовывающихся во вторую очередь является почти геометрически правильной похожая на квадрат
д) процесс кристаллизации завершается в центре капли
е) в центре кристаллизации кристаллы более правильные нежели чем по краям
ж) можно выделить зону кристаллизации по краям капли и зону кристаллизации вокруг центров кристаллизации, образующихся в центре капли
Сравнение процессов кристаллизации CuSO4 и NaCl:
а) процесс кристаллизации начинается по краям капли, то есть там, где температура низкая
б) форма первых образовавшихся кристаллов у CuSO4 неправильная нежели чем у NaCl
в) процесс кристаллизации начинается с образования центров кристаллизации, далее кристаллизация происходит в разные стороны от центров кристаллизации
г) форма кристаллов образовывающихся во вторую очередь у CuSO4 является неправильной, а у NaClпочти геометрически правильной похожая на квадрат
д) процесс кристаллизации завершается в центре капли
е) в центре кристаллизации кристаллы имеют более правильную (вследствие приближения всей системы к равновесному состоянию) и вытянутую (дендритную) форму из за ускоренного отвода тепла у CuSO4
ж) можно выделить зону кристаллизации по краям капли и зону кристаллизации вокруг центров кристаллизации, образующихся в центре капли
Вывод: на данной лабораторной работе мы изучили процесс кристаллизации и формы растущих кристаллов при кристаллизации из растворов солей.
Ответы на контрольные вопросы:
1. Кристаллическое строение веществ характеризуется закономерным размещением атомов в пространстве с образованием кристаллической решетки.
2. Многие свойства реального кристаллического вещества зависят от степени совершенства строения его кристаллической решетки. Известно, что реакционная способность реальных кристаллов тем выше, чем больше энергия их решетки отличается от энергии решетки идеального кристалла (в совершенной кристаллической решетке масс передача, необходимая для осуществления реакции в твердой фазе, практически невозможна). В связи с этим целесообразно остановиться на причинах, характере и наиболее важных следствиях этого отличия.
Идеальный кристалл состоит из правильно расположенных во всех направлениях атомов, ионов или молекул. В каждом таком кристалле существует определенная, характерная для него структурная единица или элементарная ячейка, точное повторение которой в трех измерениях образует его решетку.
Дефектами кристалла называют всякое нарушение трансляционной симметрии кристалла — идеальной периодичности кристаллической решётки. Различают несколько видов дефектов по размерности. А именно, бывают нульмерные (точечные), одномерные (линейные), дву-мерные (плоские) и трёхмерные (объемные) дефекты.
3. Кристаллизация — процесс фазового перехода вещества из жидкого состояния в твёрдое кристаллическое с образованием кристаллов. Фазой называется однородная часть термодинамической системы отделённая от других частей системы (других фаз) поверхностью раздела, при переходе через которую химический состав, структура и свойства вещества изменяются скачками.
Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или пресыщения пара, когда практически мгновенно возникает множество мелких кристалликов — центров кристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости или пара. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани. Зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов (многогранные, пластинчатые, игольчатые, скелетные, дендритные и другие формы, карандашные структуры и т. д.). В процессе кристаллизации неизбежно возникают различные дефекты.
На число центров кристаллизации и скорость роста значительно влияет степень переохлаждения.
Степень переохлаждения — уровень охлаждения жидкого металла ниже температуры перехода его в кристаллическую (твердую) модификацию. Степень переохлаждения необходима для компенсации энергии скрытой теплоты кристаллизации. Первичной кристаллизацией называется образование кристаллов в металлах (сплавах и жидкостях) при переходе из жидкого состояния в твердое.
4. Размеры кристаллов разнообразны. Одни кристаллы крупны и легко различимы невооруженным глазом, другие же настолько малы, что могут быть рассмотрены только в микроскоп.
 2015-02-24
2015-02-24 9565
9565