CaSO4е ↔ Сае2+ + SO42- е; ∆H< 0 (4.1)
Ассоциат
Химическая реакция (4.1) – гетерогенная, многостадийная.
Для описания кинетики используется модель с фронтальным перемещением зоны реакции и непрореагировавшим ядром (МФПЗРиНЯ).
Основные допущения:
Рассматривается единичная шарообразная частица ФГ в потоке жидкой реакционной смеси.
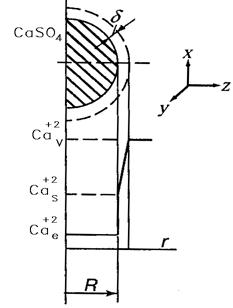
рис.5.1. Распределение концентраций веществ вблизи шарообразной частицы:
Реакционная смесь – сложная 3-х фазная, динамическая система, где
тв. фаза - частицы образующегося ФГ; неразложившиеся частицы апатита;
жидкая фаза - фосфорная, серная кислоты;
газовая фаза - гидриды.
Лимитирующая стадия всего процесса – кристаллизация фосфогипса.
Условные обозначения к рис. 5.1:
ССа2+,ν, ССа2+,s, ССа2+,e – концентрация ионов Са2+ в объеме реакционной смеси, на поверхности твердой частицы ФГ и равновесная.
R- наружний радиус тв. ч-цы ФГ
δ – толщина пограничного слоя- это диффузионный слой, в котором сосредоточено основное сопротивление массопереносу.
Rсоп = 1/β или R= 1/βг (β- коэффициент массоотдачи)
Согласно МФПЗРиНЯ можно выделить основные стадии:
1. Внешняя диффузия ионов кальция из объема РС к наружней поверхности тв. ч-цы ФГ (кривая 1-2)
Wг = - 1/S·dnj/dτ (5.1)
S- поверхность раздела фаз
Уравнение (3.3) для 1 стадии:
Wг = β(ССа2+,ν – ССа2+,s) (5.2)
β≈D/δ
Пути управления скоростью на 1 стадии:
Измельчение δ↓→β↑
При этом средний размер частиц ФГ уменьшается, соответственно фильтрующие свойства осадка фосфогипса ухудшаются (увеличивается проскок твердых частиц через слой фильтрующего материала).
2. Поверхностная реакция.
WгII= kг*(ССа,S2+ - ССа,e2+) 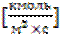 (5.3)
(5.3)
kг = [м/с] – константа скорости для гетерогенного процесса.
По уравнению Аррениуса:
kг = k0* 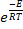 (5.4)
(5.4)
Пути управления WгII:
Из уравнения (5.4) следует, что надо увеличивать температуру.
|
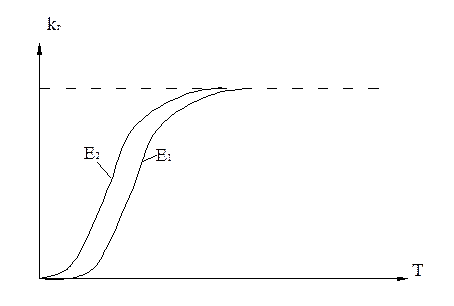
Анализ влияния температуры на растворимость ионов Са2+
|
|
|
 n
n
Лимитирующей стадией процесса образования ФГ является поверхностная реакция. Температуру поддерживают на уровне 55- 60°С не из соображений кинетики, а из-за морфологически образующегося кристалла (габитус – кристаллическая форма). При температуре 55- 60 °С образуется дендритная (игольчатая) форма кристалла (l>>d). А при температуре более 65 °С образуется кристалл сферической формы (l≈d).
Из практики эксплуатации установок по производству фосфорной кислоты установлено, что наиболее «узким» местом, лимитирующим общую производительность установки, является процесс фильтрования. Следовательно, к форме кристаллов ФГ, образующего осадок на фильтрующем материале, предъявляются большие требования (при прочих равных условиях). Осадок должен обладать хорошими фильтрующими свойствами (максимальная суммарная порозность осадка). Этому будет удовлетворять дендритная структура сульфата кальция. Поэтому в основу классификации способов получения фосфорной кислоты положен вышеназванный признак. Тогда по способам получения фосфорной кислоты различают:
§ Дигидратный ФГ;
§ Полугидратный ФГ CaSO4*0,5H2O;
§ Ангидридный (безводный) ФГ CaSO4.
 2015-02-27
2015-02-27 582
582

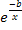 E2<E1
E2<E1







