Министерство образования и науки РФ
ГОу впо ВГУИТ
Кафедра физической и аналитической химии
Конспект лекций
По дисциплине «Физическая и коллоидная химия»
Часть
Коллоидная химия
Для студентов, обучающихся по направлениям:
Энерго- и ресурсосберегающие процессы
В химической технологии, нефтехимии и биотехнологии»,
Техносферная безопасность»,
Квалификация выпускника
Бакалавр
Воронеж 2014
Оглавление
| Предмет коллоидной химии. Основные понятия и определения………… | ||
| Глава I. Классификация и свойства дисперсных систем….……………... | ||
| 1.1 Классификация дисперсных систем…………………………….…… | ||
| Классификация по степени дисперсности…………………………... | ||
| Классификация по агрегатному состоянию………………………… | ||
| Классификация по характеру взаимодействия сплошной среды и дисперсной фазы……………………………………………………… | ||
| Классификация по структурно-механическим свойствам………… | ||
| 1.2 Основные свойства дисперсных систем…………………………….. | ||
| Глава II. Поверхностные явления…………………………………………. | ||
| 2.1. Классификация поверхностных явлений…………………………… | ||
| 2.2. Поверхностное явление – адсорбция……………………………….. | ||
| 2.2.1. Основные понятия и определения…..………………................ | ||
| 2.2.2. Адсорбция на границе жидкость – газ..……………………….. | ||
| Понятие о ПАВ………………………………………………… | ||
| Фундаментальное адсорбционное уравнение Гиббса………. | ||
| Теория мономолекулярной адсорбции Ленгмюра…………... | ||
| 2.2.3. Адсорбция на твердом адсорбенте…...……………………….. | ||
| Особенности адсорбции на твердом адсорбенте…………….. | ||
| Характеристика твердых адсорбентов. Требования, предъявляемые к твердым адсорбентам…………………………… | ||
| Основные теории адсорбции на твердых адсорбентах ….... | ||
| Уравнение Фрейндлиха……………………………………….. | ||
| Ионная адсорбция из растворов………………………………. | ||
| Ионообменная адсорбция…………………………………….. | ||
| 2.3. Адгезия и смачивание..……………………………………………… | ||
| Глава III. Электрокинетические свойства дисперсных систем. Электрокинетические явления……………….…………………… | ||
| 3.1. Возникновение электрического заряда на поверхности раздела фаз | ||
| 3.2. Современные представления о строении двойного электрического слоя (ДЭС)…………………………………….……………………… | ||
| 3.3. Строение мицеллы………………………………………..………….. | ||
| 3.4. Факторы, влияющие на электрокинетический потенциал..………… | ||
| Влияние температуры……………………………………………….. | ||
| Влияние электролитов……………………………………………….. | ||
| Влияние рН среды……………………………………………………. | ||
| Влияние природы дисперсионной среды…………………………… | ||
| 3.5. Электрокинетические явления………………………………………. | ||
| 3.5.1. Электрофорез………………………………………………….. | ||
| 3.5.2. Потенциал седиментации……………………………………… | ||
| 3.5.3. Электроосмос………………………………………………….. | ||
| 3.5.4. Потенциал течения | ||
| Глава IV. Устойчивость и нарушение устойчивости дисперсных систем.. | ||
| 4.1. Седиментационая устойчивость......………………………………. | ||
| 4.2. Агрегативная устойчивость……………………………………....... | ||
| 4.2.1. Теория устойчивости гидрофобных золей ДЛФО……….. | ||
| 4.2.2. Факторы, определяющие агрегативную устойчивость коллоидных систем | ||
| 4.3. Коагуляция гидрофобных дисперсных систем…………………… | ||
| 4.3.1. Коагуляция золя электролитами…….……………………... | ||
| Концентрационная коагуляция……………..…………….. | ||
| Нейтрализационная коагуляция.………………………… | ||
| Явления неправильных рядов…………………………….. | ||
| 4.3.2. Кинетика коагуляции………………………………………. | ||
| Теория быстрой коагуляции Смолуховского……………. | ||
| Константа скорости быстрой коагуляции………………... | ||
| Константа скорости медленной коагуляции…………….. | ||
| Глава V. Оптические свойства дисперсных систем……………………….. | ||
| 5.1. Рассеяние света......…………………………………………………. | ||
| Теория светорассеяния…………………………………………….. | ||
| 5.2. Поглощение света и окраска золей……………………………....... | ||
| 5.3. Оптические методы исследования коллоидных растворов…....... | ||
| Глава VI. Молекулярно-кинетические свойства дисперсных систем….. | ||
| 6.1. Броуновское движение….…………………………………………. | ||
| 6.2. Диффузия………………………………………………………....... | ||
| 6.3. Осмос…………………………………………………………........ | ||
| Глава VII. Виды дисперсных систем…………………………………….. | ||
| 7.1. Растворы ВМС......…………………………………………………. | ||
| 7.1.1. Классификация ВМС……………….……………………….. | ||
| 7.1.2. Особенности строения полимеров..……………………….. | ||
| 7.1.3. Набухание ВМС…………………….……………………….. | ||
| 7.1.4. Термодинамика набухания……..………………………….. | ||
| 7.1.5. Кинетика набухания………………..……………………….. | ||
| 7.1.6. Факторы, влияющие на набухание..……………………….. | ||
| 7.1.7. Свойства растворов ВМС………….……………………….. | ||
| 7.2. Коллоидные ПАВ. Мицеллообразования в растворах ПАВ......... | ||
| Применение коллоидных ПАВ……………………………………. | ||
| 7.3. Эмульсии…………………………………………………….…....... | ||
| 7.3.1. Классификация эмульсий……….…………………………... | ||
| 7.3.2. Методы получения эмульсий……...……………………….. | ||
| 7.3.3. Устойчивость эмульсий..………….……………………….. | ||
| 7.3.4. Применение эмульсий……………..……………………….. | ||
| 7.4. Пены | ||
| 7.4.1. Методы получения пен…………....……………………….. | ||
| 7.4.2. Устойчивость пен……….………….……………………….. | ||
| 7.4.3. Методы разрушения пен………….……………………….. | ||
| 7.4.4. Практическое применение пен…….……………………….. |
ВВедение в дисциплину
Предметом изучения дисциплины «Поверхностные явления и дисперсные системы» являются свойства и явления, происходящие в дисперсных системах.
Дисперсное состояние системы предполагает наличие огромной границы раздела фаз (межфазной поверхности), возникающей между дисперсной фазой и дисперсионной средой. Молекулы конденсированных фаз, находящиеся в поверхностном слое, обладают избыточной энергией по сравнению с молекулами в объеме из-за нескомпенсированности их межмолекулярных взаимодействий. В результате возникает поверхностный слой (межфазная поверхность), образованный молекулами разной природы и обладающий избытком энергии – поверхностной энергией.
В этой связи процессы, происходящие в этих системах, локализуются на межфазной поверхности и сопровождаются понижением поверхностной энергии. Эти процессы называют поверхностными явлениями. Например, к ним относятся: адсорбция, адгезия, смачивание, образование ДЭС и др.
Дисперсные системы очень широко распространены в природе и технике. Примеры: лаки, краски, нефть, атмосфера, грунт и другие природные объекты. В курсе рассматривают системы с размером частиц дисперсной фазы 10-9 - 10-7 м (1-100 нм).
В курсе физической химии мы рассматривали системы, в которых поверхность раздела не играла существенной роли. Чтобы поверхностные явления были ощутимы, поверхность раздела должна быть развита, что достигается дроблением одной из фаз.


 Пример:
Пример:
Чрезвычайно развитую поверхность раздела фаз имеют дисперсные системы.
Любая дисперсная система состоит из двух и более фаз, т.е. гетерогенна (рис. 2).







 Раздробленную (прерывную) часть дисперсной системы называют дисперсной фазой 1, а нераздробленную (непрерывную) – дисперсионной (сплошной) средой 2.
Раздробленную (прерывную) часть дисперсной системы называют дисперсной фазой 1, а нераздробленную (непрерывную) – дисперсионной (сплошной) средой 2.
|
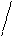
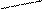







Количественной характеристикой межфазной поверхности дисперсных систем является удельная поверхность – площадь раздела фаз, приходящаяся на единицу массы или объема дисперсной фазы
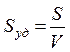 , м-1 или
, м-1 или 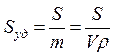 , м2/г,
, м2/г,
где S, V, m, r – площадь, объем, масса и плотность частицы соответственно.
Если частицы дисперсной фазы имеют форму куба с длиной ребра а и одинаковы по размерам, то
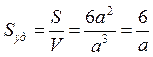 .
.
Для частиц сферической формы радиуса r
S = 4p r 2, V = 4/3p r 3, 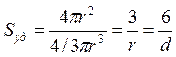 .
.
В общем случае для систем, содержащих частицы произвольной формы
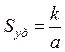 ,
,
где k – коэффициент, зависящий от формы частиц; а – выбранный линейный размер частиц (характерный размер).
Дисперсность D – величина, обратная характерному размеру
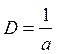 .
.
Рассмотрим, как влияет дробление фазы на ее удельную поверхность.
Форма фазы – куб.
| а, м | Sуд, м-1 |
| 10-1 | |
| 10-5 | 6×105 |
| 10-7 | 6×107 |
| 10-9 | 6×109 |
Вывод: с уменьшением размера частиц (при дроблении) резко возрастает удельная поверхность дисперсной фазы.
Глава I.
Классификация и свойства дисперсных систем
1.1. Классификация дисперсных систем
Нет единого способа классификации дисперсных систем.
Классифицировать дисперсной системы можно на основе следующих общих признаков:
1) по степени дисперсности;
2) по агрегатному состоянию дисперсной фазы и дисперсионной среды;
3) по характеру взаимодействия дисперсной фазы и дисперсионной среды;
4) по структурно-механическим свойствам.
Классификация по степени дисперсности
В зависимости от размеров частиц различают высокодисперсные, среднедисперсные и грубодисперсные системы
| Класс | Размер частиц, м | Дисперсность | Примеры |
| Высокодисперсные | 10-9-10-7 | 109-107 | Гидрозоли |
| Среднедисперсные | 10-7-10-5 | 107-105 | Растворимый кофе, сахарная пудра |
| Грубодисперсные | >10-5 | <105 | Крупы |
| Истинные растворы | <10-9 |
Частицы с размерами <10-9 м образуют молекулярные или ионные растворы.
 2015-02-27
2015-02-27 1758
1758







