1. Большая удельная поверхность раздела фаз достигается за счет раздробленности дисперсной фазы. Чем меньше характерный размер частиц дисперсной фазы, тем больше удельная поверхность.
2. Раздробленность и большая удельная поверхность раздела фаз обусловливают значительный избыток поверхностной энергии на межфазной поверхности.
Задача: оценить количественно избыточную поверхностную энергию.
Рассмотрим систему жидкость-газ.

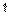





 1-й случай: молекула находится в объеме жидкости. Со всех сторон она окружена такими же молекулами. Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса) взаимно уравновешиваются. Получается симметричное силовое поле, т.е. векторы сил направлены в разные стороны, но равны по модулю.
1-й случай: молекула находится в объеме жидкости. Со всех сторон она окружена такими же молекулами. Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса) взаимно уравновешиваются. Получается симметричное силовое поле, т.е. векторы сил направлены в разные стороны, но равны по модулю.
Равнодействующая сил равна 0.
2-й случай: молекула находится на поверхности раздела; с одной стороны на нее действуют молекулы жидкости, а с другой – молекулы газа. притяжение со стороны молекул газа, естественно, слабее притяжения со стороны молекул жидкости. В результате несимметричности силового поля возникает результирующая сила, направленная внутрь более плотной фазы (жидкой). Эту силу часто называют внутренним давлением. Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды оно составляет 14800 атм. Поэтому капельные жидкости при увеличении внешнего давления не изменяют свой удельный вес, т.е. они несжимаемы.
Для всех молекул поверхностного слоя нереализованная способность к взаимодействию со стороны одной из фаз (в данном случае газовой) характеризует свободную поверхностную энергию G пов, которая и обусловливает протекание различных поверхностных процессов.
Важная характеристика поверхности – поверхностное натяжение s, которое равно термодинамически обратимой, изотермической работе, которую необходимо совершить, чтобы увеличить площадь межфазной поверхности на единицу.
Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого необходимо совершить работу против внутреннего давления, стремящегося втянуть молекулы поверхностного слоя внутрь фазы.
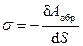 ,
,
где d А обр – термодинамически обратимая работа, затраченная на образование поверхности площадью d S; так как работа совершается над системой, она отрицательна.
[s] = Дж/м2 = Н/м
1) V, T = const
-d A = d F, где F – энергия Гельмгольца,
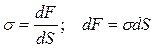 .
.
2) p, T = const
-d A = d G, где G – энергия Гиббса,
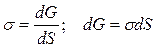 .
.
Таким образом, поверхностное натяжение – это удельная свободная поверхностная энергия, т.е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности.
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше s.
Вопрос: чему будет равно s, если воздействие на молекулы в поверхностном слое со стороны молекул газа будет таким же, как со стороны жидкости?
Ответ: s = 0. Молекулы на поверхности будут испытывать аналогичные воздействия со стороны соседних молекул. Скомпенсированность межмолекулярного взаимодействия означает, что граница раздела между фазами исчезла и система из гетерогенной превратилась в гомогенную.
В результате действия s текучие системы принимают форму с минимальной поверхностью фазы при заданном объеме. Поэтому такие жидкости называют капельными.
Поверхностное натяжение позволяет поверхности воды выдерживать вес водяного паука, а пауку шагать по поверхности воды. (Привести пример с иголкой).
Поверхностное натяжение на границе двух конденсированных фаз называет межфазовым. Оно образуется на поверхности раздела двух взаимно нерастворимых жидкостей, твердого тела с жидкостью и двух твердых тел и обозначается соответственно sж-ж, sт-ж, sт-т.
Поверхностное натяжение с ростом температуры снижается. Это связано с ростом давления насыщенного пара и уменьшением нескомпенсированности межмолекулярного взаимодействия. Поэтому при оценке значений s необходимо указывать температуру.
При 293 К s воды составляет 72,75 мДж/м2, подсолнечного масла – 33, сырого молока – 45-60, а сухих вин – 46-52 мДж/м2, что ниже s воды.
 2015-02-27
2015-02-27 741
741








