Крекинг метановых углеводородов. Влияние температуры и давления на химизм крекинга углеводородов. Радикально-цепной механизм крекинга углеводородов. Пути образования свободных радикалов и их реакция. Стадии радикально-цепного механизма термического распада углеводородов. Химизм и механизм термических превращений этиленовых, нафтеновых, ароматических углеводородов. Сравнение химизма превращения углеводородов в различных промышленных процессах термической переработки нефтяного сырья.
План лекции
1. Механизм крекинга
2. Состав продуктов крекинга
3. Химизм термических превращений углеводородов
1. Термические реакции имеют радикально-цепной характер. Цепными реакциями называются реакции, которые состоят из ряда параллельно-последовательных реакций, в которых участвуют как радикалы, так и валентно-насыщенные молекулы. Стадии: зарождение цепи, при которой образуются свободные радикалы, имеющие неспаренный электрон; продолжение цепи; обрыв цепи.
В термических реакциях процессов крекинга, пиролиза коксования энергия, необходимая для разрыва связей в молекуле одного из реагентов, подводится в виде тепла. Тогда, например, имеем:
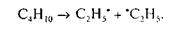
Разрыв происходит таким образом, чтобы в результате образовался наиболее устойчивый радикал. Устойчивость радикала возрастает в следующем ряду:
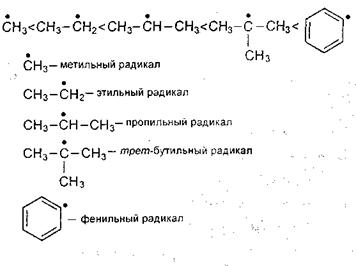
Повышение устойчивости радикалов связано со стабилизацией свободного электрона за счет индукционных и мезомерных эффектов в этом радикале. Радикалы, стабилизированные за счет сопряжения с ароматической системой связей, являются самыми устойчивыми и в то же время наименее реакционноспособными.
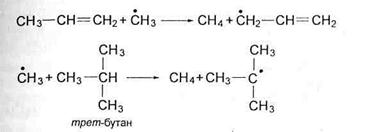
Образовавшийся нестабильный радикал, обладая, напротив, наибольшей реакционной способностью, начинает цепь превращений, ведущих к образованию продуктов реакции. Например:
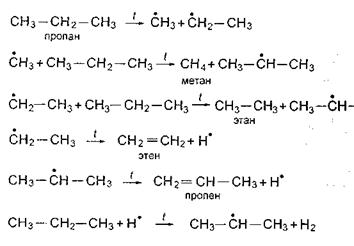 -сн3
-сн3
Обрыв цепи приводит либо к исчезновению радикалов, либо к образованию нереакционноспособного стабильного радикала. Квадратичный обрыв происходит при взаимодействии двух радикалов. Он характерен для жидкофазных реакций:
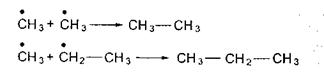
Линейный обрыв цепи чаще встречается при газофазных реакциях. Он происходит при адсорбции активных радикалов на стенке или другой твердой поверхности либо на ингибиторах.
Ингибиторы — вещества, приводящие к гибели активных радикалов по различным механизмам. Для термических реакций такими веществами могут быть амины, фенолы, органические соединения серы и даже сами углеводороды (олефины), изопарафины и ароматические углеводороды, образующие более стабильные радикалы, чем участвующие в данной цепи реакций.
2. Химический состав продуктов каталитического крекинга имеет характерные особенности: бензин содержит много изопарафинов и ароматических углеводородов; газ получается тяжелый с высокой концентрацией изобутана и олефинов C3-C4; газойлевые фракции богаты полициклическими ароматическими углеводородами. Это своеобразие состава обуславливают следующие причины:
- Различие механизма термического и каталитического крекинга; термический крекинг протекает по радкально-цепному механизму, а каталитический крекинг – по ионному;
- Способность активной поверхности катализатора селективно ускорять некоторые реакции, например, изомеризацию олефинов, скорость которой при термическом процессе крайне мала.
Каталитический крекинг типичный пример гетерогенного катализа. Реакция протекает при границе двух фаз: твердой (катализатор) и паровой или жидкой (сырье), поэтому решающее значение имеет структура и поверхность катализатора.
Постадийно процесс каталитического крекинга можно представить следующим образом:
- Поступление сырья к поверхности катализатора;
- Диффузия (внутренняя) молекул сырья в поры катализатора;
- Хемосорбция молекул сырья на поверхности катализатора, т.е. на активных центрах;
- Химическая реакция на катализаторе;
- Десорбция продуктов крекинга и непрореагировавшего сырья с поверхности и диффузия из пор катализатора;
Удаление продуктов крекинга и неразложившегося сырья из зоны реакции.
3. Алканы в условиях термического крекинга распадаются с образованием парафина и олефина. Причем, чем больше молекулярная масса алкана, тем ближе к середине молекулы произойдет разрыв. Низкомолекулярные алканы, такие, как этан, пропан и бутан, могут подвергаться реакции дегидрирования. Метан в условиях крекинга не разлагается.
 |
Следует отметить, что при распаде молекулы на неравные осколки углеводород с меньшим молекулярным весом получается предельным, а с большим — непредельным.
Олефины в термических реакциях в зависимости от условий в основном претерпевают распад на алкены и алкины с меньшей молекулярной массой, но возможны реакции полимеризации и уплотнения, т. с. циклизации с последующей конденсацией.
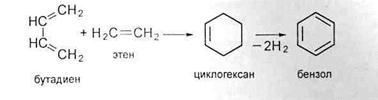
Для нафтенов характерны следующие группы реакций:
1. деалкилирование или укорочение боковых парафиновых цепей;
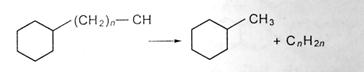
4. дегидрирование нафтенового кольца с образованием циклоолефинов и ароматических углеводородов;
частичная или полная дециклизация полициклических нафенов после деалкилирования;
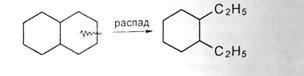
5. распад моноциклических нафтенов на олефины
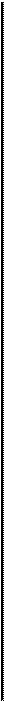
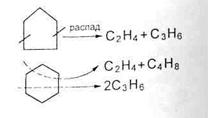
 Ароматические углеводороды термически устойчивы и поэтому накапливаются в продуктах термических процессов. Ароматические углеводороды с длинными боковыми цепями способны деалкилироваться с образованием преимущественно монометилированных ароматических углеводородов.
Ароматические углеводороды термически устойчивы и поэтому накапливаются в продуктах термических процессов. Ароматические углеводороды с длинными боковыми цепями способны деалкилироваться с образованием преимущественно монометилированных ароматических углеводородов.
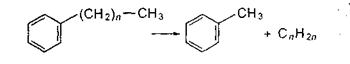
Ароматические углеводороды без заместителей (голоядерные) и ароматические углеводороды с низким числом углеродных атомов в цепи практически не подвергаются распаду. В условиях термических процессов они способны конденсироваться с выделением водорода. 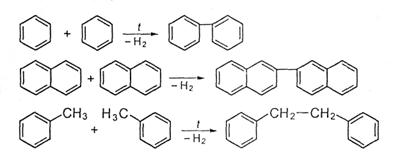
В результате образуются высококонденсированные нелетучие и нерастворимые в хинолине вещества, из которых затем получается твердый углеродистый остаток — кокс или сажа.
Контрольные вопросы
1. Радикально-цепной механизм крекинга углеводородов
2. Механизм термических превращений этиленовых, нафтеновых ароматических углеводородов
3. Влияние температуры на крекинг углеводородов
Лекция 13.
Основные тенденции в развитии процессов каталитических превращений углеводородов в нефти. Основные типы промышленных катализаторов превращения углеводородов. Стадии гетерогенно-каталитических превращений углеводородов.
Гидрогенизационные процессы переработки углеводородов нефти. Катализаторы гидрогенизации и деструктивной гидрогенизации. Химизм превращения углеводородов и неуглеводородных компонентов нефти в процессах гидрокрекинга и гидроочистки.
План лекции
1. Катализаторы термокаталитических процессов
2. Химизм гидрогенизационных процессов
3. Катализаторы гидрогенизации
1. Катализаторы характеризуются активностью, стабильностью и селективностью. Активность катализатора — это его удельная производительность. Чем активнее катализатор, тем меньше времени и самого катализатора необходимо для получения продукта. Селективность катализатора определяется количеством целевого продукта, образовавшегося из исходного сырья. Поскольку термокаталитические процессы — это процессы, результате которых образуется очень много различных веществ далеко не все из них являются целевыми, то селективность катализатора является важной характеристикой. Стабильность катализатора, т. е его способность сохранять (поддерживать) свою активность во времени — один из важнейших показателей качества катализатора.
Катализаторы термокаталитических процессов, за исключением процесса алкилирования, представляют собой сложную систему, которая состоит из трех компонентов: носитель, основной компонент и вспомогательные добавки. В качестве носителя используются алюмосиликаты, вещества, химический состав которых может быть выражен средней формулой пА1203 х mSi02 x уН20. Как основной компонент катализатора применяют цеолиты.
В качестве добавок используют платину, рений, металлоорганические комплексы сурьмы, висмута, фосфора или олова, оксиды кальция и магния и др. Вспомогательные добавки улучшают или придают некоторые специфические физико-химические или механические свойства цеолитсодержащим алюмосиликатным катализаторам. Так, введение малых концентраций платины (<0,1 % мас) позволяет значительно повысить скорость реакции гидрирования-дегидрирования. Добавки СаО или MgO позволяют катализатору сорбировать в б—10 раз больше металлов, содержащихся в нефтяных фракциях и ухудшающих качество продукции, чем катализатору без добавок.
Характер вспомогательных добавок изменяется в зависимости от процесса. Для катализаторов каталитического крекинга используют гидроксиды тугоплавких металлов: титана, циркония, ванадия, рения и некоторых металлов платиновой группы (рутения, осмия, иридия и платины).
2.  Гидрогенизационные процессы нашли широкое применение в нефтепереработке и нефтехимии. Их используют для получения стабильных высокооктановых бензинов, улучшения качества дизельных и котельных топлив, а также смазочных масел. В нефтехимической промышленности с помощью реакций гидрирования получают циклогексан и его производные, многие амины, спирты и ряд других мономеров. Быстрое развитие гидрогенизационных процессов в последние годы объясняется повышением требований к качеству товарных нефтепродуктов, значительным стяжением стойкости производства водородов и созданием высокоэффективных катализаторов.
Гидрогенизационные процессы нашли широкое применение в нефтепереработке и нефтехимии. Их используют для получения стабильных высокооктановых бензинов, улучшения качества дизельных и котельных топлив, а также смазочных масел. В нефтехимической промышленности с помощью реакций гидрирования получают циклогексан и его производные, многие амины, спирты и ряд других мономеров. Быстрое развитие гидрогенизационных процессов в последние годы объясняется повышением требований к качеству товарных нефтепродуктов, значительным стяжением стойкости производства водородов и созданием высокоэффективных катализаторов.
В нефтеперерабатывающей промышленности гидрогенизационные процессы используют для регулирования углеводородного и фракционного состава перерабатываемых нефтяных фракций, удаления из них серо – и азотосодержащих соединений, улучшение эксплуатационных характеристик нефтяных топлив, масел и сырья для нефтехимии. Основные гидрогенизационные процессы.
1. Гидроочистка нефтяных фракций от серо -, азот – и кислород органических соединений с целью повышения качества продуктов или подготовки к дальнейшей переработке;
2. Гидрирование алкенов и аренов в нефтяных фракциях;
3. Гидрокрекинг нефтяных фракций.
Гидроочистка - процесс удаления из нефтепродуктов гетероатомных, непредельных соединений и аренов в среде водорода на катализаторе. Термодинамический процесс гидроочистки низкотемпературный. Для быстрого протекания реакций на существующих промышленных катализаторах достаточна температура 330-3800С. поскольку реакция присоединения водорода сопровождается уменьшением объема, давления в реакционной зоне. Гидроочистка нефтяных фракций проводится при 380-4200С под давлением 2,5 –4,0 МПа присутствии ЛКМ катализаторов. Соотношение водород: сырье в м3 обычно составляет (300-600):1.
Гидрокрекинг применяют для получения бензина, реактивного и дизельного топлив или сырья для термического и каталитического крекинга. Проводят процесс при температуре
380-5000С и давлении водорода до 15-20 МПа.
3. Катализаторы гидрогенизационных процессов являются сложными полифункциональными системами, представляющими собой носитель и различные активные добавки. В качестве носителя используют оксиды алюминия, кремния, магния либо алюмосиликаты, цеолиты, иногда фосфаты. Применение носителя позволяет не только уменьшить количество активных компонентов в катализаторе, но и использовать его собственные возможности. Алюмосиликаты и цеолиты обладают кислотными центрами, что придает катализатору дополнительно изомеризующие и расщепляющие (крекирующие) свойства. Металлы VIII группы (Ni, Co, Pt,Pd, Fe) оксиды или сульфиды
VI (Mo, W, Cr) периодической системы используют в качестве активных добавок. Причем введение добавки зависит от качества сырья. Если сырье сернистое или высокосернистое, то применяют стойкие к отравляющему действию сернистых соединений сульфиды металлов VI группы. Оксидные катализаторы обладают повышенной сорбцией полярных групп органических веществ. Поэтому на таких катализаторах легче гидрируются соединения по функциональным группам с сохранением ненасыщенных или ароматических связей. Это катализаторы-полупроводники, и используются они в процессах гидроочистки.
Контрольные вопросы
1. Основные катализаторы крекинга
2. Гидрогенизационные процессы переработки нефти
3. Катализаторы гидрогенизационных процессов
4. Химизм превращения углеводородов в гидрокрекинге и гидроочистке
 2015-02-27
2015-02-27 7325
7325








