Согласно принципу Ле-Шателье, при уменьшении концентрации H2O равновесие сместилось в сторону прямой реакции, т.е. концентрации CO2 и H2 уменьшились, а концентрации CO и H2O увеличились на одинаковую величину, так как все вещества реагируют в одинаковом соотношении.
Обозначим изменение концентрации всех веществ через х моль/л. После смещения равновесия новые равновесные концентрации реагирующих веществ C (моль /л) стали такими, как указано в таблице.
Составляем таблицу изменения концентраций.
| Концентрации | Вещества | |||
| CO2 | H2 | СO | H2O | |
| C | ||||
| ∆ C | X | X | X | X |
| C’ | 7 – x | 5 – x | 10 + x | 11 + x |
Константа равновесия данной реакции равна:
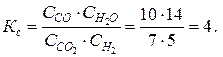
Подставляем новые равновесные концентрации C’ в выражение для константы равновесия Kс:.
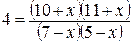 .
.
Найдем корни этого уравнения:
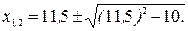
Корень х1 = 22,6 мы отбрасываем, поскольку уменьшение концентрации CO2 и H2 не может быть большим, чем исходные концентрации этих веществ. Поэтому реальным будет корень x2 = 0,44 моль/л. Тогда новыми равновесными концентрациями будут:
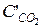 = 7 – 0,44 = 6,56 моль/л;
= 7 – 0,44 = 6,56 моль/л; 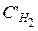 = 5 – 0,44 = 4,56 моль/л;
= 5 – 0,44 = 4,56 моль/л;
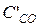 = 10 + 0,44 = 10,44 моль/л;
= 10 + 0,44 = 10,44 моль/л; 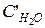 = 11 + 0,44 = 11,44 моль/л.
= 11 + 0,44 = 11,44 моль/л.
Пример 4. Вычислите константу равновесия при Т = 298 К для реакции 2NO2(Г) Á N2O4(Г), пользуясь значениями ∆ G 0298.
 2015-02-27
2015-02-27 598
598







