Метод разработан Вильштеттером и Шудлем. В основу метода положена реакция окисления альдегидной группы сахаров в соответствующую одноосновную кислоту. Например, глюкоза окисляется в глюконовую кислоту по уравнению:
СН2ОН (СНОН)4СОН + J2 +2NaОН = СН2ОН (СНОН)4СОН +NaJ + Н2О.
По приведенному уравнению процесс окисления сахаров протекает лишь в слабощелочной среде и при комнатной температуре. Щелочь добавляют в количестве, достаточном для нейтрализации образующейся кислоты, при этом щелочность среды не должна превышать рН 9. Кетозы в этих условиях не окисляются, что позволяет определять глюкозу в присутствии фруктозы.
В сильнощелочной среде и при повышенной температуре альдозы окисляются в двухосновные кислоты, происходит также окисление кетоз, и результаты анализа значительно завышаются.
Количество окислившегося сахара определяют по разности между объемом раствора йода, взятого на окисление сахара, и объемом его избытка. Избыток йода определяют титрованием тиосульфата натрия в кислой среде в присутствии крахмала.
Кислоту перед титрованием добавляют в строго определенном количестве, так как в сильно кислой среде образовавшиеся при окислении сахаров йодит и йодат натрия, вступая в реакцию с кислотой, выделяют свободный йод:
NaJО3 +5 NaJ +3Н2SO4 = 3J2 + 3Na2 SO4 + 3 Н2О.
Этот йод также оттитровывается тиосульфатом натрия, и результаты анализа сильно занижаются.
Крахмал добавляют в конце титрования, чтобы уменьшить адсорбцию на нем йода.
Содержание сахара в анализируемой пробе рассчитывают по уравнению реакции окисления, из которой видно, что на окисление одной молекулы сахара идет 2 атома йода. Для глюкозы эквивалент по йоду равен 180: 2 = 90 г, а для мальтозы 342: 2 = 171 г, где 180 и 342 – массы молекул сахаров. Следовательно, 1 см3 0,1н раствора йода эквивалентен 0,009 г глюкозы и 0,0171 г мальтозы.
Для анализа готовят растворы, содержащие не больше 0,5% сахара.
Метод широко используется для определения редуцирующих сахаров в сусле, активности амилолитических ферментов солода и грибных культур, при химическом определении крахмала в зерне и других анализах. Ниже приводится методика определения мальтозы в пивном сусле.
Аппаратура и реактивы. Конические колбы на 200 см3; мерная колба на 250 см3; пипетки на 10, 15 и 50 см3; мерные цилиндры на 100 см3; 0,1н раствор йода; 0,1н раствор тиосульфата натрия; 1 н раствор гидроксида натрия; 1 н раствор серной кислоты; 1% раствор крахмала.
Ход определения. В мерную колбу на 250 см3 пипеткой отмеривают 10 см3 сусла, объем колбы доводят до метки водой и перемешивают. Затем 50 см3 раствора пипеткой вносят в коническую колбу, сюда же пипеткой (или из бюретки) добавляют 25 см3 0,1 н раствора йода, из цилиндра 3 см3 1 н раствора щелочи. Колбу закрывают пробкой, содержимое колбы перемешивают и ставят в темное место, чтобы избежать обратных фотохимических процессов. Через 15-20 минут к смеси добавляют 4,5 см3 1 н раствора серной кислоты и титруют 0,1н раствором тиосульфата натрия до светло-желтой окраски. Затем прибавляют несколько капель раствора крахмала и медленно, при энергичном взбалтывании, по каплям приливают раствор тиосульфата натрия до исчезновения синей окраски крахмала.
Содержание мальтозы х (в граммах на 100 см3) вычисляют по формуле:
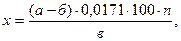 (17)
(17)
где а – объем 0,1 н раствора йода, взятый на реакцию окисления, см3;
б – объем 0,1 н раствора тиосульфата, пошедшего на титрование избытка
йода, см3;
n – коэффициент разведения сусла;
в – объем раствора сусла, взятый на реакцию окисления, см3.
Определение ведут в двух параллельных пробах, расхождение между которыми не должно превышать 0,1-0,2 см3 раствора йода.
По точности получаемых результатов методы, основанные на йодометрическом определении закисной или окисной меди после окисления сахаров, равноценны перманганатным методам. Параллельные определения дают расхождения, не превышающие 0,3%. Но эти методы имеют преимущество в смысле быстроты анализа, поскольку отпадает довольно трудоемкий процесс фильтрования и растворения закиси меди (метод Бертрана).
Йодометрический метод Вильштеттера, основанный на прямом окислении сахара йодом, имеет еще выгодное отличие от методов, основанных на применении фелинговой жидкости, так как реакция идет в строго стехиометрических отношениях. Это обеспечивает высокую точность метода при меньшем искажающем влиянии условий анализа на результаты определения.
Таким образом, химические методы определения углеводов, основанные на редуцирующих свойствах сахаров, являются сами по себе точными методами. При непосредственном определении сахаров, имеющих свободную альдегидную группу, они довольно быстры и оперативны.
Таблица 6 – Содержание мальтозы в образцах пивного сусла в зависимости от суток брожения
| Сутки сбраживания сусла | Содержание мальтозы, в г на 100 см3 сусла по методу | |
| Бертрана | Вильштеттера и Шудля | |
| Охмеленное сусло | ||
| Вторые сутки брожения | ||
| Четвертые сутки брожения | ||
| Седьмые сутки брожения (молодое пиво) |
 2015-02-27
2015-02-27 4925
4925
