Пример 1. По данным о квантовых числах и числе электронов (Ne) на валентных орбиталях составьте электронную формулу атома, укажите название этого элемента, период и группу, к которой он принадлежит: n = 4, l = 1, Ne = 6.
Решение. Значения главного (n) и орбитального (l) квантовых чисел говорят о том, что элемент находится в четвертом периоде и относится к семейству p -элементов. Внешний энергетический уровень атома элемента содержит шесть электронов:... 4 s 2 4 р 4. Такую конфигурацию внешнего энергетического уровня имеет атом селена, полная электронная формула следующая:
Se: 1 s 22 s 22 р 63 s 23 р 63 d 104 s 24 р 4
Селен находится в 4 периоде, в VIA группе.
Пример 2. Опишите методом валентных связей электронное строение молекулы AlCl3 и ионов AlO2−, [Al(OH)4]−, [AlCl6]3−, тип гибридизации АО атома алюминия, число и тип химических связей, геометрическую форму частиц и угол между связями.
Решение. В нормальном состоянии структура внешнего энергетического уровня атома алюминия следующая:
 |
W = 1
Структура внешнего энергетического уровня атома алюминия в возбужденном состоянии.

W = 3
В образовании химических связей в атоме алюминия могут принимать участие один электрон 3 s -орбитали и два электрона 3 р -орбитали (по обменному механизму), а также вакантные 3 р - и 3 d -орбитали по донорно-акцепторному механизму.
При образовании молекулы AlCl3 возникают три гибридных электронных облака (sp 2-гибридизация). Молекула АIСI3 имеет форму плоского треугольника, валентный угол между связями 120°.
При образовании ионов АIО2−, [АI(ОН)4]− и [АIСI6]3− возникают следующие гибридные электронные облака соответственно: sp -, sp 3-, sp 3 d 2- гибридизации. Пространственная конфигурация и угол связи:
АIО2− - линейная форма, 180°;
[АI(ОН)4]− - тетраэдр, 109,5°;
[АIСI6]3− - тетрагональная бипирамида, 90°.
В ионе AIO2− - две s -связи и одна делокализованная p -связь:
[-О-АI 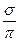 O ] = [-О = АI-О] или [ О = АI = О ]-
O ] = [-О = АI-О] или [ О = АI = О ]-
В остальных частицах существуют только s -связи:
AlCl3 - 3 s -связи; А[I(ОН)4]− - 4 s -связи (одна из них образована по донорно-акцепторному механизму); [AICI6]3− - 6 s -связей (три - по донорно-акцепторному механизму, три иона Сl− передают три пары электронов на три вакантные орбитали атома АI).
Пример 3. Какая из связей, Ca-F или Сa-CI, наиболее полярна? Какое из соединений, CaF2 или СаСI2, плавится при более высокой температуре?
Решение. Чем выше ионность связи, тем больше температура плавления соли. Для определения полярности связи необходимо найти разность электроотрицательностей (Δ ЭО) в приведенных парах атомов:
Δ ЭО Ca-F = 4,0 − 1,0 = 3,0; Δ ЭО Сa-CI = 2,8 − 1,0 = 1,8.
Чем больше разность электроотрицательностей соединяющихся атомов, тем более полярна связь, тем ближе она к ионной. Наиболее полярной является связь Ca-F. Общее электронное облако смещается в сторону атома с большей электроотрицательностью, т.е. в сторону атома фтора в первом примере, хлора во втором примере.
Ионные соединения в твердом состоянии - это совокупность ионов, удерживаемых вместе сильным электростатическим взаимодействием.
Следовательно, CaF2 как более ионное соединение плавится при более высокой температуре (t пл CaF2 = 1423°C, t пл CaCl2 = 728°С).
Пример 4. Напишите электронную формулу атома элемента и назовите его, если значения квантовых чисел (n, l, ml, ms) электронов внешнего электронного слоя следующие: 4,0,0,+1/2; 4,0,0,-1/2; 4,1,-1,+1/2; 4,1,0,+1/2; 4,1,1,+1/2; 4,1,-1,-1/2.
Решение. Состояние каждого электрона внешнего энергетического уровня определяется следующим набором квантовых чисел:
| 1-й электрон | n = 4 | l = 0 | ml = 0 | ms = +1/2 |
| 2-й электрон | n = 4 | l = 0 | ml = 0 | ms = -1/2 |
| 3-й электрон | n = 4 | l = 1 | ml = -1 | ms = +1/2 |
| 4-й электрон | n = 4 | l = 1 | ml = 0 | ms = +1/2 |
| 5-й электрон | n = 4 | l = 1 | ml = +1 | ms = +1/2 |
| 6-й электрон | n = 4 | l = 1 | ml = +1 | ms = -1/2 |
Главное квантовое число (n) равно четырем, следовательно, электроны находятся на 4-м энергетическом уровне.
Орбитальное квантовое число (l), определяющее форму орбитали равно 0 и 1, следовательно, электроны находятся на s - и p -подуровне.
Магнитное квантовое число (ml) определяет ориентацию орбитали в пространстве и число орбиталей на подуровне. В данном примере четыре орбитали.
На s -орбитали находится два электрона (ms = ±1/2). На трех p -орбиталях (px, py, pz) находится четыре электрона.
Внешний энергетический уровень атома этого элемента содержит шесть электронов: …..4 s 24 p 4.
Такую электронную конфигурацию внешнего энергетического уровня имеет атом селена Se, полная электронная формула которого следующая: 1 s 22 s 22 p 63 s 23 p 64 s 24 p 4.
Вопросы для самоподготовки
1. Что такое атомная орбиталь?
2. Может ли магнитное квантовое число по своему значению превышать значение главного квантового числа того же электронного слоя?
3. Может ли химическая связь между атомами осуществляться одним электроном?
4. Какими показателями характеризуют прочность химической связи?
5. Чем должны обладать химические частицы для установления между собой химической связи по ковалентному механизму?
6. Чем определяется валентность элемента в конкретном соединении?
7. В чем состоит главная причина гибридизации атомных орбиталей, участвующих в образовании химических связей?
8. Какие атомные орбитали могут гибридизоваться?
9. Какой тип гибридизации атомных орбиталей наиболее часто осуществляется в неорганических соединеиях?
10. Что такое координационное число атома в его соединении?
11. Что является мерой полярности химической связи?
ТЕСТЫ
1. Сколько квантовых чисел характеризуют состояние электрона в атоме?
а) 6;
б) 2;
в) 4;
г) 5.
2. Какому элементу соответствует следующее строение внешнего электронного уровня:
 3p
3p
а) титан;
б) алюминий;
в) кремний;
г) сера.
3. В какой из приведенных ниже частиц нет π-связей?
а) SO3;
б) CO2;
в) K2O;
г) MgO.
4. У какого из перечисленных веществ тетраэдрическая форма молекулы?
а) ВеCI2;
б) AIF3;
в) СCI4;
г) SCl6.
5. В каком соединении ионная связь?
а) FrF;
б) CCI4;
в) NH3;
г) SO2.
 2015-02-27
2015-02-27 6899
6899
