Под классификацией химических соединений понимают объединение разнообразных и многочисленных соединений в определенные
группы или классы, обладающие сходными свойствами.
Индивидуальные химические вещества принято делить на две группы: простые и сложные:
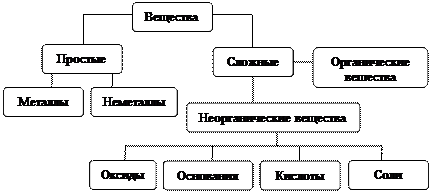 |
Перед тем, как рассмотреть более подробно каждый из классов неорганических соединений, рассмотрим нижеприведенную схему.
 |
Основные оксиды H2O Кислотные оксиды
 (СuO), CaO (SO3), SO2
(СuO), CaO (SO3), SO2
 |  | ||||
|
Основания H2S Кислоты
(Cu(OH)2), Ca(OH)2 бескислородные (H2SO4), H2SO3
кислородные
|
Номенклатура. Если соединение образуетс кислородом одно соединение, то его называют оксидом соответствующего элемента: Na2O – оксид натрия; AI2O3 – оксид алюминия. Если элемент образует несколько оксидов, то после названия элемента указывается степень его окисле-
ния (римской цифрой в скобках): CrO3 – оксид хрома (VI); CrO – оксид хрома (II); Cr2O3 – оксид хрома (III).
По химическим свойствам оксиды подразделяются в соответствии со схемой:
 |
Соединения элемента с кислородом, в котором атомы кислорода связаны друг с другом и имеют степень окисления (–1), называются пероксидами: Na2O2 – пероксид натрия.
Характер оксида определяется положением соответствующего элемента в таблице Д.И. Менделеева. В периоде слева направо металлические свойства ослабляются и усиливаются неметаллические, а в главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабляются.
Металлы образуют основные оксиды, а неметаллы - кислотные. Следовательно, в периодах слева направо основные свойства оксидов элементов ослабляются и усиливаются кислотные. В главных подгруппах сверху вниз ослабляются кислотные и усиливаются основные свойства оксидов.
Элементы главных (А) подгрупп
рост металлических свойств
 |
| Периоды | Группы элементов | ||||||
| Li | Be | B | C | N | O | F | |
| Na | Mg | Al | Si | P | S | Cl | |
| K | Ca | Ga | Ge | As | Se | Br | |
| Rb | Sr | In | Sn | Sb | Te | I | |
| Cs | Ba | Tl | Pb | Bi | Po | At |
В главных подгруппах границей между элементами, образующими основные и кислотные оксиды, являются элементы, оксиды которых амфотерны и расположены на диагонали-вертикали: Be-AI-Ge-Sn-Pb.
Правее и выше линии (Be-Al-Ge-Sn-Рb) расположены элементы, образующие кислотные оксиды. Исключение составляют элементы V группы – Аs и Sb в степени окисления +3, оксиды которых амфотерны, и Bi (+3) и Po (+4), оксиды которых основные. Аs и Sb в степени окисления +5 образуют кислотные оксиды.
Левее и ниже линии (Re-AI-Ce-Sn-Рb) находятся элементы, образующие основные оксиды. Исключением являются элементы III группы – Gа и In, оксиды которых амфотерны.
Оксиды некоторых элементов побочных подгрупп имеют свойства:
Ag2O, CdО, CoO, NiO, Cu2O, FeO, HgO – основные;
ZnO, Sc2O3, Au2O3, Cr2O3 – амфотерные.
Если элемент образует оксиды в нескольких степенях окисления, то оксиды, соответствующие высшим степеням окисления элемента, проявляют кислотные свойства, а низшим – основные свойства. Оксиды с промежуточными степенями окисления проявляют амфотерные свойства.
Например:
MnO – основной, CrO – основной,
MnO2 – амфотерный, Cr2O3 – амфотерный,
MnO3 – кислотный, CrO3 – кислотный.
Mn2O7 – кислотный.
Основные оксиды образуют только металлы. Например, К2О, FeO, СаО; им соответствуют основания КОН, Fе(ОН)2, Са(ОН)2. Оксиды щелочных и щелочноземельных металлов (металлы IA группы и Ca, Sr, Ba) растворяются в воде с образованием щелочей:
Na2O + Н2O→2NaOH
CaO + Н2O→Ca(OH)2
Оксиды остальных металлов нерастворимы в воде и не взаимодействуют с ней. Соответствующие им основания получают косвенно.
Основные оксиды взаимодействуют с кислотами, кислотными оксидами и кислыми солями с образованием солей:
Na2O + СО2→Na2CO3
CaO + 2HCl→CaCl2 + H2O
K2O + 2KHSO4→2K2SO4 + H2O
Кислотные оксиды образуют неметаллы (Cl2O7, B2O3, CO2, N2O5, SO3, Cl2O и др.), а также металлы d -типа IV-VII групп периодической системы в высшей степени окисления (V2O5, СгО3, Мn2O7, WO3 и др.).
Кислотные оксиды – ангидриды (т.е. обезвоженные формы) соответствующих кислот. Большинство кислотных оксидов растворимы в воде и взаимодействуют с ней, образуя кислоты:
SO3 + H2O→H2SО4
СrО3 + Н2О→H2CrО4
Однако известно немало кислотных оксидов, которые в воде не растворяются и с ней не взаимодействуют (SiO2, V2O5, Sb2O5 и др.). Соответствующие им кислоты получают косвенно.
Некоторые оксиды в зависимости от условий могут присоединять разное число молекул воды, образуя мета - и орто -кислоты:
P2O5 + H2O→2HPO3 - метафосфорная кислота
P2O5 + 3H2O 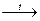 2H3PO4 - ортофосфорная кислота
2H3PO4 - ортофосфорная кислота
Способность образовывать орто- и метакислоты зависит от атомного радиуса элемента: чем меньше радиус, тем устойчивее метаформа.
Существуют кислотные оксиды, содержащие атом элемента в промежуточной степени окисления, которые при взаимодействии с водой образуют смесь двух кислот:
2NO2 + H2O→HNO3 + HNO2
Такие оксиды с основаниями или основными оксидами образуют смесь солей соответствующих кислот:
2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
Кислотные оксиды взаимодействуют с основными оксидами, основаниями и с основными солями, образуя соли:
N2O5 + 2NaOH→2NaNO3 + H2O
СО2 + К2О→К2СО3
SО3 + 2FeOHSО4→Fe2(SО4)3 + H2О
Амфотерные оксиды в зависимости от условий проявляют свойства основных и кислотных оксидов (BeО, ZnO, Al2О3, Cr2О3, PbO, PbО2, SnO, SnО2). Оксиду ZnOсоответствует гидроксид цинка Zn(OH)2 и цинковая кислота H2ZnO2; оксиду АI2О3 соответствует гидроксид AI(OH)3и ортоалюминиевая Н3АlO3 или метаалюминиевая кислота НАlO2 и т.д. Амфотерные оксиды реагируют с кислотами (кислотными оксидами), основаниями (основными оксидами), кислыми и основными солями, образуя соли:
Cr2O3 + 6HCl→2CrCl3 + 3H2О
АI2О3 + 3N2O5→2Al(NO3)3
Cr2O3 + 2NaOH→2NaCrO2 + H2O
Al2O3 + Na2O 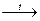 2NaAlO2
2NaAlO2
ZnO + 2NaHSO4→ZnSO4 + Na2SO4 + H2O
ZnO + 2CaOHCI→CaZnO2 + CaCI2 + H2O
Амфотерные оксиды не растворяются в воде и с ней не реагируют.
Гидроксиды Э(ОН) m (гидраты оксидов) подразделяются на три группы:
 |
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода Н+ (точнее ионы гидроксония H3O+).
Кислоты классифицируют:
· по растворимости;
· по количеству ионов водорода: одноосновные (HCl, HCN); двухосновные (H2SO4), трехосновные (H3РО4);
· по наличию атомов кислорода: бескислородные (H2S, HCl, HF, H2Te, H2Se) и кислородсодержащие (H2SO4, HNO2, HClO, HСlO4);
· по способности образовывать ионы: на сильные (HCl, HNO3, H2SO4 и др.) и слабые (H2S, H2CO3, HCN, H2SO3 и др.). В pастворах слабые кислоты присутствуют в основном в виде молекул.
Кислоты взаимодействуют с основными оксидами, основаниями, солями, металлами и неметаллами с образованием солей:
2HCl + СаО→СаСI2 + Н2О
H2SO4 + 2КОН→K2SO4 + 2Н2О
H2SO4 + K2SiO3→H2SiO3 + K2SO4
HCl + ZnOHCl→ZnCl2 + H2О
2HCI + Mg→MgCl2 + H2
Сu + 2Н2SО4(конц.)→CuSO4 + SO2 + 2Н2О
S + 6HNO3(конц.)→H2SО4 + 6NO2 + 2H2О
Основания – электролиты, которые при диссоциации в водных растворах в качестве анионов образуют гидроксид-ионы ОН−:
Основания классифицируются:
· по числу гидроксильных групп: одно-, двух, трех и т.д.- кислотные (NaOH, Ca(OH)2, AI(OH)3);
· по отношению к воде на нерастворимые и растворимые, называемые щелочами (образованные металлами IA и IIA групп, кроме Mg, Be);
· по отношению к нагреванию: нерастворимые основания разлагаются на два оксида (2Cr(OH)3 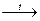 Cr2O3 + 3H2O); растворимые не разлагаются, могут кипеть и перегоняться;
Cr2O3 + 3H2O); растворимые не разлагаются, могут кипеть и перегоняться;
· по способности к диссоциации в водных растворах на сильные (NaOH, Ca(OH)2) и слабые (Сu(ОН)2, AI(OH)3).
Основания взаимодействуют с кислотными оксидами, кислотами, солями:
2NaOH + SiO2→Na2SiO3 + Н2О
KOH + HCl→KCl + H2O
Cu(OH)2 + H2SO4→CuSO4 + 2H2O
3KOH + AlCl3→¯Al(OH)3 + 3KCl
Ca(OH)2 + Ca(HCO3)2→3CaCO3 + 2H2O
Амфотерными называются гидроксиды, способные диссоциировать и по типу оснований (с образованием ОН− - ионов) и по типу кислот (с образованием H+ - ионов), например,
ZnОН+ + OH−→Zn(OH)2→H2ZnO2→H+ + НZnO2−
Каждое из этих равновесий – ступенчатое; 1-я ступень диссоциации выражена сильнее остальных.
К амфотерным гидроксидам относятся: Zn(ОН)2, Ве(ОН)2, AI(OH)3, Cr(OH)3, Pb(OH)2, Рb(ОН)4, Sn(OH)2, Sn(OH)4, и др.
Все амфотерные гидроксиды не растворяются в воде. Характером диссоциации амфотерных гидроксидов объясняется их способность взаимодействовать как с кислотами, так и с основаниями, образуя соли:
2АI(ОН)3 + 3H2SO4→АI2(SО4)3 + 6H2О
Al(OH)3 + NaOH 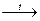 NaAIO2 + 2H2O или
NaAIO2 + 2H2O или
АI(ОН)3 + 3NaOH 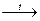 Na3AIO3 + 3H2O
Na3AIO3 + 3H2O
Растворение амфотерных гидроксидов в щелочных растворах рассматривается как процесс образования гидроксосолей (гидроксокомплексов): [Zn(OH)4]2−, [Al(OH)4]−, [Al(OH)6]3−
Например: Аl(ОН)3 + NaOH(р-р)→Na[Al(OH)4]
тетрагидроксоалюминат натрия,
Al(OH)3 + 3NaOH(р-р)→Na3[AI(OH)6]
гексагидроксоалюминат натрия.
Таким образом, ввиду двойственного характера амфотерные гидроксиды имеют два названия, например: Zn(ОH)2 (или H2ZnO2) гидроксид цинка или цинковая кислота; АI(ОН)3 (или Н3АIО3) - гидроксид алюминия или ортоалюминиевая кислота.
Соли – электролиты, которые при диссоциации образуют катионы металлов и анионы кислотных остатков:
Э n А m ↔nЭ m + +mА n −
В зависимости от состава различают следующие типы солей: средние (нормальные), кислые, основные, двойные, смешанные и комплексные.
Средние соли – продукты полного замещения атомов водорода на металл: MgSO4, Al2(SO4)3, Na3PO4. В молекулах средних солей нет незамещенных ионов H+ или OH−. Любую соль можно представить как продукт взаимодействия основания и кислоты, т.е. реакции нейтрализации, например:
2NaOH + H2SO4→Na2SO4 + 2Н2О
Уравнение диссоциации средней соли можно записать:
Na2SO4→2Na+ + SO42−
Средние соли взаимодействуют:
CuSO4 + 2NaOH→Сu(ОH)2 + Na2SO4
CuSO4 + H2S→CuS + H2SO4
СaСl2 + Na2CO3→CaCO3 + 2NaCl
Zn + Hg(NO3)2→Zn(NO3)2 + Hg
Названия средних солей составляют из латинского названия аниона в именительном падеже, а катиона – в родительном. Если один и тот же металл проявляет различную степень окисления, то ее указывают в скобках римской цифрой. Например, KNO3 – нитрат калия, NaCl – хлорид натрия, FeSO4 – сульфат железа (II), Fe2(SO4)3 – сульфат железа (III).
Кислые соли – продукты неполного замещения атомов водорода в кислоте на металл, в молекулах кислых солей всегда есть незамещенные ионы водорода, например:
NaOH + H2SО4→NaHSO4 + Н2О
Кислые coли проявляют свойства кислот и солей. Взаимодействуют с металлами, оксидами, основаниями и солями:
Мg(HSO4)2 + Mg→2MgSO4 + Н2
2NaHSO4 + Mg→MgSO4 + Na2SO4 + H2
Ca(HCO3)2 + CaO→2CaCO3 + H2O
Са(НСО3)2 + Са(ОН)2→2СаСО3 + 2Н2О
2NaHSO4 + Na2CO3→2Na2SO4 + CO2 + Н2О
Названия кислых солей производят добавлением к аниону приставки гидро -, а если необходимо, то с соответствующим числительным:
NaHSO4 – гидросульфат натрия, КН2РО4 – дигидроортофосфат калия.
Основные соли – продукты неполного замещения гидроксогрупп оснований на кислотные остатки. В молекулах основных солей есть незамещенные гидроксид-ионы основания, например:
Mg(OH)2 + HCl→MgOHCI + H2O
Основные соли проявляют свойства оснований и солей. Они реагируют с кислотами, кислыми солями, ангидридами кислот и щелочами:
AlOH(NO3)2 + HNO3→Al(NO3)3 + H2O
2FeOHSO4 + SO3→Fe2(SO4)3 + H2O
MgOHCl + NaOH→Mg(OH)2 + NaCl
2FeOHSO4 + 2NaHSO4→Fe2(SO4)3 + 2H2O + Na2SO4
Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставки гидроксо-:
AlOHSO4 – сульфат гидроксоалюминия; Al(OH)2Cl – хлорид дигидроксоалюминия.
Смешанные соли: KAl(SO4)2, (NH4)2Fe(SO4)2.
Двойные соли: CaCO3∙MgCO3.
Комплексные соли: K3[AI(OH)6], K2[HgJ4].
Вопросы для самоподготовки
1. По каким признакам классифицируют химические соединения?
2. Какие соединения называются оксидами, кислотами, основания-ми, солями?
3. Составьте химические и графические формулы соединений: ортокремниевая кислота, сульфат алюминия, гидросульфит магния, гидросульфид калия, гидрокарбонат бария, иодид гидроксостронция, нитрат гидроксохрома (III), сульфат дигидроксожелеза (III).
4. Напишите формулы оксидов, соответствующие указанным гидроксидам (KOH, H2SO4, Be(OH)2). Укажите кислотно-основные свойства оксидов и подтвердите химическими реакциями в молекулярном виде. Назовите полученные соединения.
5. Приведите молекулярные уравнения реакций получения солей (кислых, основных, средних) при взаимодействии гидроксидов H4SiO4, Mn(OH)2, Sn(OH)2 с а) HCl; б) NaOH. Назовите полученные соли. Если взаимодействие не происходит, объясните причину.
6. Назовите соединения, приведите их графические формулы: H3PO4, Ca(OH)2, Cr2(SO4)3, KMnO4, NaHSO3, Ca(H2PO4)2, (ZnOH)2SeO4, SO3.
7. Составьте молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения:
Li®LiOH®LiH2PO4®Li2HPO4®Li3PO4
Be®BeCl2®Be(OH)2®Na2[Be(OH)4]®BeCl2
8. Закончите уравнения реакций и назовите полученные соединения.
Li2O + P2O5®; Cr2O3 + NaOH®; ZnO + Na2O®;
CO2 + Mg(OH)2®; CaOHNO3 + HCl®; NaHCO3 + NaOH®;
Na2HPO4 + NaOH®; Mg(HSO4)2 + MgOHNO3®.
9. Составьте в молекулярном виде реакции получения всех возможных солей при взаимодействии гидроксида цинка и сернистой кислоты.
10. С какими из перечисленных ниже веществ будут реагировать серная кислота, гидроксид калия: Ba(NO3)2, ZnO, AICI3, CO2, Mg, Cu(OH)2, NaHCO3, Al, FeOHCI2, Be(OH)2. Напишите уравнения соответствующих реакций.
ТЕСТЫ
1. Вставьте в уравнения реакций пропущенные соединения:
а) SO2 +... = K2SO3;
б) H2SO4 +... =... + H2O;
в) KOH +... = AgOH +...;
г) NaCl +... = PbCI2 +....
2. Какие из перечисленных гидроксидов одновременно являются кислотами?
а) Ba(OH)2;
б) Be(OH)2;
в) Mn(OH)2;
г) Fe(OH)2.
3. Сколько кислых солей может быть получено при взаимодействии гидроксида калия и ортофосфорной кислоты?
а) ни одной;
б) три;
в) две;
г) одна.
4. Какие из приведенных реакций записаны неправильно:
а) KOHSO3 + CaHNO2 = KSO3 + CaNO2 + H2O;
б) Ca(OH)2 + 2NaOH = NaCaO2 + 2Н2О;
в) SO3 + K2O = K2SO4;
г) 3K2HPO4 + 3NaOH = 2K3PO4 + Na3PO4 + 3Н2О?
5. Из какого соединения можно получить негашеную известь?
а) карбонат кальция;
б) сернистая кислота;
г) гидроксид кальция.
 2015-02-27
2015-02-27 2440
2440
