Наряду с массой и объемом в химических расчетах часто используется количество вещества, пропорциональное числу содержащихся в веществе структурных единиц. При этом в каждом случае должно быть указано, какие именно структурные единицы (молекулы, атомы, ионы т.д.) имеются в виду. Единицей количества вещества является моль.
В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12С.
1 а.е.м. = 1/12 m (12С) = 1,66057 ∙ 10-27 кг = 1,66057 ∙ 10−24 г.
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С.
Относительная молекулярная масса вещества (Мr) – это безразмерная величина, равная отношению массы молекулы вещества к 1/12 массы атома 12С. Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекул.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень невелико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12С.
Число моль (n), содержащееся в веществе массой m г, определяют по формуле:
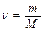 ,
,
где m – масса вещества, г; М – молекулярная масса вещества, г/моль.
 2015-02-27
2015-02-27 372
372








