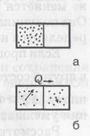
 Рассмотрим процесс расширения газа. Пусть имеется сосуд с перегородкой (рис. а) в левой части которого есть газ, а в правой – нет. Уберем перегородку. Газ расширится и займет обе части. Если молекулы друг с другом не взаимодействуют (идеальный газ), то общая внутренняя энергия при таком процессе не изменится (UI =UII). Однако состояние II отличается от состояния I тем, что тело из состояния II самопроизвольно, без вмешательства извне не вернется в состояние I. Если молекул мало, например 2 или 3, то, двигаясь хаотически, случайно, они все могут в какой-то момент оказаться в левой части, но если молекул много, то это крайне маловероятно. Поэтому процесс расширения газа в пустоту называют необратимым.
Рассмотрим процесс расширения газа. Пусть имеется сосуд с перегородкой (рис. а) в левой части которого есть газ, а в правой – нет. Уберем перегородку. Газ расширится и займет обе части. Если молекулы друг с другом не взаимодействуют (идеальный газ), то общая внутренняя энергия при таком процессе не изменится (UI =UII). Однако состояние II отличается от состояния I тем, что тело из состояния II самопроизвольно, без вмешательства извне не вернется в состояние I. Если молекул мало, например 2 или 3, то, двигаясь хаотически, случайно, они все могут в какой-то момент оказаться в левой части, но если молекул много, то это крайне маловероятно. Поэтому процесс расширения газа в пустоту называют необратимым.
Другой пример: пусть газ находится и слева и справа от теплопроводной перегородки, но температура слева выше, чем температура справа (рис. б). Молекулы обмениваются с перегородкой кинетической энергией, и постепенно температуры обеих частей выравниваются. Такой процесс передачи тепла всегда необратим. Самопроизвольно средняя кинетическая энергия молекул (т. е. температура) слева сама не поднимется за счет кинетической энергии молекул справа.
Любой процесс, сопровождающийся трением, также необратим, так как при этом энергия упорядоченного движения переходит в энергию беспорядочного движения молекул, т. е. в теплоту.
 2015-02-04
2015-02-04 376
376








