Пусть с рабочим веществом совершаются циклы, при каждом из которых подводится от нагревателя Q1, отдается холодильнику Q2 и производится работа
А = Q1 – Q2. Из (38) и (39) можно получить:
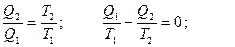 (40).
(40).
Величина Qi /Ti называется приведенной теплотой. Обозначим ее Δ Si. Из (40) следует, что сумма приведенных теплот при циклическом процессе равна нулю. Это означает, что, какой бы циклический процесс мы ни совершали, если мы вернулись в исходное состояние, некоторая величина S не меняется ( Δ S = 0). Следовательно, S – функция состояния. Она получила название энтропии. Таким образом, состояние определяется не только внутренней энергией U, но и энтропией S. Если процесс не циклический и тело переходит из состояния 1 в другое состояние 2, то 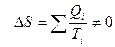 . Когда тело получает теплоту (Q > 0), его энтропия возрастает, когда теряет (Q < 0) – энтропия уменьшается. При адиабатическом процессе (Q = 0) ΔS = 0 и S=const, поэтому адиабатический процесс называют еще изоэнтропийным.
. Когда тело получает теплоту (Q > 0), его энтропия возрастает, когда теряет (Q < 0) – энтропия уменьшается. При адиабатическом процессе (Q = 0) ΔS = 0 и S=const, поэтому адиабатический процесс называют еще изоэнтропийным.
Рассмотрим теплопередачу при контакте двух тел при температурах Т1 и Т2 (Т1 > Т2) в теплоизолированной системе. Теплота Q, передаваемая телом 1, равна теплоте Q, полученной телом 2. Однако, тело 1 отдает ее при температуре Т1 и 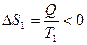 , а тело 2 получает ее при температуре Т2 и
, а тело 2 получает ее при температуре Т2 и 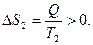 Так как Т1 > T2, следовательно, │Δ S 2│>│Δ S 1│, так что в целом при таком процессе энтропия возрастает. Т.о., при необратимых процессах энтропия увеличивается.
Так как Т1 > T2, следовательно, │Δ S 2│>│Δ S 1│, так что в целом при таком процессе энтропия возрастает. Т.о., при необратимых процессах энтропия увеличивается.
|
|
|
В тепловой машине часть теплоты, взятой от нагревателя, преобразуется в работу, а другая часть должна быть передана холодильнику. Нагреватель охлаждается, а холодильник нагревается.
С одной стороны, мы знаем, что при этом энтропия возрастает. С другой стороны, к.п.д. такой тепловой машины будет постепенно падать, так как 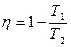 и при Т1 → T2 к.п.д. η → 0. Общая энергия системы, включающей нагреватель, холодильник, рабочее вещество и тело, над которым производится работа, остается неизменной, но работы получается все меньше и меньше. В пределе, когда Т1 = T2, теплота от нагревателя не может быть использована вовсе. Тогда внутренняя энергия нагревателя становится бесполезной. Таким образом, возрастание энтропии соответствует обесцениванию энергии.
и при Т1 → T2 к.п.д. η → 0. Общая энергия системы, включающей нагреватель, холодильник, рабочее вещество и тело, над которым производится работа, остается неизменной, но работы получается все меньше и меньше. В пределе, когда Т1 = T2, теплота от нагревателя не может быть использована вовсе. Тогда внутренняя энергия нагревателя становится бесполезной. Таким образом, возрастание энтропии соответствует обесцениванию энергии.
Энтропию можно связать со степенью упорядоченности системы. Увеличение энтропии соответствует увеличению беспорядка. Энтропия – это мера беспорядка. В наших примерах (рис.) система переходила из менее вероятного, упорядоченного, неравновесного состояния в более вероятное, неупорядоченное, равновесное.
Вычислим изменение энтропии для идеального газа, исходя из дифференциальных выражений для изменения энтропии и I начала термодинамики:
|
|
|
dS=δQ / T; 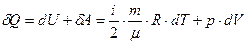 (41)
(41)
Учитывая, согласно уравнению Клапейрона, что 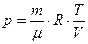 , и подставив p в δ Q, а δ Q в выражение для d S, получим:
, и подставив p в δ Q, а δ Q в выражение для d S, получим:
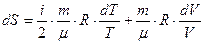 , которое после интегрирования определяет изменение энтропии идеального газа при переходе от состояния 1 с Т 1 и V 1 к состоянию 2 с Т 2 и V 2:
, которое после интегрирования определяет изменение энтропии идеального газа при переходе от состояния 1 с Т 1 и V 1 к состоянию 2 с Т 2 и V 2: 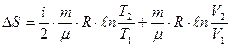 (42).
(42).
 2015-02-04
2015-02-04 490
490








