Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся: понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотической давление.
Если растворенное вещество – электролит, то число частиц, находящихся в растворе, будет больше числа молекул за счет их диссоциации. Это приводит к большему понижению упругости пара, а понижение температуры замерзания окажется больше того, которое отвечает имеющейся моляльной концентрации, а найденная молярная масса (кажущаяся) окажется меньше истинной.
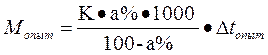 ,
,
где а – массовая доля вещества в растворе; К- криоскопическая константа: ∆ tопыт - понижение температуры в опыте.
Посчитав по химической формуле электролита истинную молярную массу, легко найти степень диссоциации:
α = 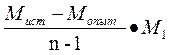 ,
,
где М ист – истинная молярная масса; М опыт – кажущаяся молярная масса.
Степень диссоциации может быть найдена по другой формуле:
α= 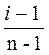 ,
,
где i - коэффициент Вант-Гоффа;
n - число ионов, на которое подвергается распаду молекула электролита.
Законы Рауля и Вант-Гоффа можно применять к растворам электролитов с учетом так называемого изотонического коэффициента (i), который показывает, во сколько раз число частиц (молекул и ионов), образовавшихся в результате диссоциации, больше исходного числа молекул. Так как i>1, формулы, выражающие свойства растворов электролитов, примут следующий вид:
∆tзам = iКСm
i = 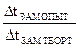 =
= 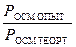 =
= 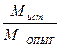
Если известна процентная концентрация исследуемого раствора, то ∆tзам находят по формуле:
∆tзам теор = 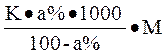 ист
ист
∆tоп находят практически, как разность температур замерзания растворителя и раствора:
∆tоп= ∆tзам ра-ля - ∆tзам ра-ра
Осмотическое давление. Непосредственное определение осмотического давления по закону Вант-Гоффа представляет ряд неудобств и трудностей:
РОСМ= СRТ,
где С – молярная концентрация раствора; Р - осмотическое давление раствора; R – газовая постоянная; Т – температура раствора.
Поэтому осмотическое давление находят косвенно методом криоскопии.Между осмотическим давлением и понижением температуры замерзания соответствующего раствора существует простое численное соотношение:
Р = 12,04 ∆t зам,
где Р – осмотическое давление при температуре 0°С,
∆t зам – измеренное понижение температуры замерзания.
РОСМ = 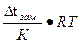
 2015-02-04
2015-02-04 851
851








