Задача 1. Какова должна, быть, концентрация водного раствора глюкозы, чтобы раствор этот при 291°К был изотоничен с раствором, содержащим 0,5 моль СаСl2, если кажущаяся степень диссоциации последнего при указанной температуре равна 65,4%?
Решение: Запишем уравнение диссоциации электролита:
СaCl2 = Сa2+ + 2Cl – n = 3
α= 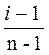 , отсюда: i =1+α(n-1)
, отсюда: i =1+α(n-1)
По условию задачиα = 0,654, тогда:
i = 0,654 (3 – 1) + 1 = 0.654 – 2 + 1 = 1,308 + 1 = 2,308
Pосм. = iCRT = 2,308•0,5•0,082•291 = 27,53 атм.
R = 0,082 л∙атм/град
Pосм. = Рглюкоз. = СRT
С = 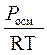 =
= 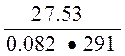 = 1,65 моль/л
= 1,65 моль/л
Ответ: 1,65 моль/л
Задача 2. Вычислить молекулярную массу сахара и осмотическое давление раствора при 00С, если раствор, содержащий 0,342 г сахара в 10 г воды, замерзает при температуре минус 0,1860С.
Решение: 1)по закону Рауля ∆tзам = КСm
Сm= 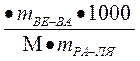 ∆tзам =
∆tзам = 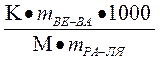
∆ tзам = 0-(-0,186) = 0,1860С
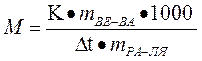
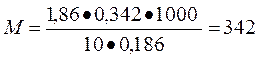
2) по закону Вант – Гоффа осмотическое давление молярного раствора неэлектролита при 00С равно 22,4 атм, а понижение температуры замерзания 1,86.
Pосм. = СRТ= 1·0,082·273 = 22,4 атм, где
R – универсальная газовая постоянная 0,082 л/атм
С – молярная концентрация (в случае разбавленных водных растворов числа, выражающие молярную и моляльную концентрацию данного раствора, близки между собой и без большой погрешности их можно приравнивать друг к другу).
Следовательно при ∆tзам = 1,86 осмотическое давление 22,4 атм
при ∆tзам = 0,186 осмотическое давление 2,24 атм
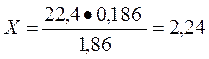 атм
атм
Ответ: 342; 2,24 атм
Задача 3. 1,4 г соли сульфата алюминия растворены в 84 г воды. Понижение температуры замерзания раствора 0,40С. Вычислите степень диссоциации.
Решение: ∆tтеор = 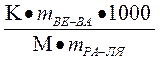 ∆tопыт = 0,4
∆tопыт = 0,4
i = 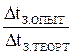 α=
α= 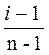 , где
, где
i – коэффициент Вант –Гоффа МAl2(SO4)3= 342
n – число ионов соли
∆tтеор = 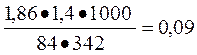 Al2(SO4)3 ↔ 2Al3++ 3SO42- n=5
Al2(SO4)3 ↔ 2Al3++ 3SO42- n=5
i = 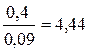 α=
α= 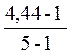 = 0,86 α=86%
= 0,86 α=86%
Ответ: 0,86
 2015-02-04
2015-02-04 2380
2380
