Явление поглощения одним веществом других веществ называется сорбцией. Процесс поглощения всей массой (всем объёмом) тела называется абсорбцией. Адсорбция – чисто поверхностное явление, которое заключается во взаимодействии молекул или ионов адсорбата (газа или растворенного вещества) с поверхностью адсорбента. В случае адсорбции поглощающее вещество называется адсорбентом; оно может быть в твердом или жидком состоянии. Вещество, скапливающееся на поверхности адсорбента – адсорбтивом или адсорбируемым веществом. В качестве адсорбтива могут быть молекулы или ионы газов, паров или растворенных веществ.
Различают физическую и химическую адсорбцию (хемосорбцию). Они различаются природой сил, действующих между адсорбатом и адсорбентом.
При физической адсорбции действуют силы межмолекулярного взаимодействия, главными из которых являются силы Ван – дер – Ваальса, также другие силы физической природы: силы взаимодействия постоянных и индуцированных диполей. Действие этих сил является слабым, и время пребывания частиц на поверхности мало, что не приводит к изменению химической природы адсорбата и адсорбента.
|
|
|
При хемосорбции имеет место химическое взаимодействие между частицами адсорбата и адсорбента за счет большей, чем при физической адсорбции энергии взаимодействия, при этом происходит перераспределение электронов между сосуществующими фазами, в результате чего на поверхности образуется новое химическое соединение, например, оксид металла при контакте кислорода с металлической поверхностью.
Явление адсорбции обусловлено наличием некомпенсированного силового поля у молекул, атомов или ионов, находящихся в поверхностном слое адсорбента. Эта ненасыщенность сил притяжения поверхностных молекул создает избыточную свободную энергию поверхности, называемую поверхностной энергией.
В процессе адсорбции происходит уменьшение свободной энергии поверхности вследствие притяжения к ней частиц адсорбируемого вещества.
По мере насыщения адсорбента увеличивается скорость обратного процесса - десорбции (отрыв частичек адсорбтива от адсорбента). Когда скорость адсорбции становится равной скорости десорбции, устанавливается динамическое адсорбционное равновесие. Концентрация вещества, соответствующая установившемуся равновесию, называется равновесной. Адсорбция зависит от природы адсорбента и адсорбтива, от температуры, давления газа или концентрации растворенного вещества.
Адсорбентами (поглотителями) являются уголь, силикагель, глина, каолин, целлюлоза, фильтровальная бумага, шерсть и другие материалы. Вещества в очень раздробленном состоянии (коллоидное состояние) обладают значительной адсорбционной способностью вследствие очень большой поверхности.
|
|
|
Величина адсорбции из растворов может быть вычислена по формуле; составленной на основе логических рассуждений:
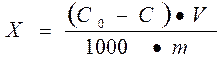 , где
, где
X – количество адсорбированного вещества в молях;
Со – концентрация растворенного вещества до адсорбции в молях или эквивалентах на литр;
С – концентрация растворенного вещества после адсорбции в молях или эквивалентах на литр;
V – объем раствора в литрах;
m – масса адсорбента в граммах;
1000 - перевод молей в миллимоли.
Зависимость между концентрацией растворенного вещества и величиной адсорбции дают уравнения Лэнгмюра и Фрейндлиха.
Уравнение Лэнгмюра термодинамически обосновано. Оно имеет вид:
Г= 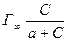 , где
, где
Г – величина адсорбции в молях на единицу массы адсорбента;
Г ∞ – предельная величина адсорбции в тех же единицах;
с – равновесная концентрация адсорбтива, выражаемая обычно в ммоль или миллиэквивалент на 1 литр раствора;
а – постоянная величина, численно равная равновесной концентрации, при которой половина поверхности адсорбента занята молекулами адсорбтива.
Уравнение Фрейндлиха установлено экспериментально. Для адсорбции из растворов оно имеет вид:
X = КС 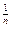 , где
, где
X – величина адсорбции на единицу массы;
С – равновесная концентрация адсорбтива
К и n – постоянные величины.
Графическая зависимость, устанавливаемая приведенными выше уравнениями, изображается кривыми, которые называются изотермами адсорбции. Чем больше найдено экспериментальных точек, тем точнее может быть построена изотерма адсорбции. Для проверки, является ли данный процесс физической адсорбцией, обычно пользуются линейной формой уравнения.
Из уравнения Лэнгмюра линейная форма получается делением единицы на левую и правую часть уравнения:
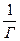 =
= 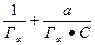 ,
,
Из уравнения Фрейндлиха линейную форму получают логарифмированием:
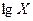 =
= 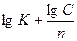 ,
,
Этому уравнению в координатах lgС (ось абсцисс) и lgX (ось ординат) отвечает прямая линия. Для построения прямой требуется, меньшее число точек, чем для построения кривой сложной формы.
Уравнение Фрейндлиха применимо к случаю адсорбции недиссоциирующих или слабо диссоциирующих веществ, когда вещество адсорбируется молекулярно (в виде молекул). Молекулярная адсорбция обратима и всегда понижается с увеличением температуры.
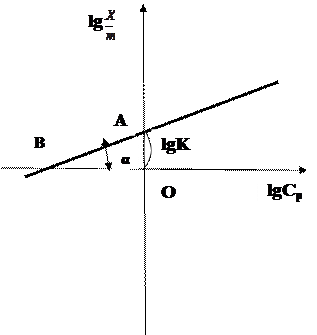
Рис. 8. Логарифмическая форма изотермы адсорбции Фрейндлиха.
Почвы являются многофазными гетерогенными системами, обладающими адсорбционной способностью. Величина адсорбции находится в прямой зависимости от удельной поверхности (суммарная поверхность частиц одного грамма адсорбента). Почвы, содержащие в своем составе большое количество
мелких частиц, т. е. имеющие большую удельную поверхность, обладают большей адсорбционной способностью, чем почвы с крупными частицами (например, черноземная и песчаная).
 2015-02-04
2015-02-04 2168
2168
