Опыт проводят по одному из вариантов (указанных преподавателем):
1. Вода – бензол 2. Вода – ксилол 3. Вода – толуол
Готовят по 50 мл растворов уксусной кислоты следующих концентраций:
Таблица 15
| № | Концентрация, н | Концентрация, н | Концентрация, н | Концентрация, н |
| 0,5 | 0,25 | 0,125 | ||
| 0,8 | 0,4 | 0,2 | 0,1 | |
| 0,5 | 0,25 | 0,125 | 0,06 | |
| 0,4 | 0,2 | 0,1 | 0,05 |
Растворы готовить путем разбавления 1 н раствора уксусной кислоты. Рассчитывают количество мл 1 н раствора кислоты необходимое для приготовления 50 мл раствора нужной концентрации. пользуясь основной формулой объемного анализа:
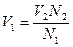 . где
. где
V1 – объем исходного раствора (1 н) кислоты;
N 1 – концентрация 1 н раствора кислоты;
V2 – объем раствора кислоты заданной концентрации (50 мл);
N 2 – заданная концентрация раствора кислоты
Отмеривают пипеткой вычисленное количество мл кислоты, переносят ее в мерную колбу на 50 мл и разбавляют дистиллированной водой до метки, тщательно перемешивают полученный раствор.
Точную концентрацию приготовленных растворов кислоты определить 3-х кратным титрованием аликвотной пробы (2 мл) 0,1 н раствором гидроксида натрия (гидроксида калия) в присутствии фенолфталеина.
В четыре делительные воронки (или колбы с притертыми пробками) налить по 25 мл бензола и по 25 мл приготовленных растворов кислоты определенной концентрации. Воронки (или колбы) закрыть пробками и сильно встряхивать в течении 10-15 минут, время от времени отрывая и закрывая пробки. Смеси оставить для расслаивания на 25-30 минут. После того как произойдет расслаивание, нижний слой жидкости из делительной воронки слить в заранее приготовленные стаканы. Из каждого стакана отобрать пробы по 2 мл на титрование.
Если опыт проводится в колбах, то отбор проб из нижнего слоя производить пипеткой, которую перед погружением в расслоившуюся смесь закрыть пальцем и провести пипетку через бензольный слой. Не открывая пипетки, нагреть ее рукой, чтобы вытеснить каплю бензольного слоя, которая может попасть в пипетку. После этого набрать необходимое количество жидкости из нижнего слоя. Каждый раствор оттитровывают трижды и берут среднее значение. Результаты титрования заносят в таблицу 16.
Таблица 16
Результаты титрования и расчетов.
| № | объем 0,1 н щелочи, мл | объем кислоты, перешедшей в бензол | Коэффициент распределения | |
| исходного | равновесного | |||
Объем щелочи, который пошел на титрование, буде пропорционален концентрации уксусной кислоты в воде – С, а разница между исходной концентрацией и равновесной дает концентрацию кислоты в бензольном слое:
С-С1=С2
Для расчета коэффициента распределения можно воспользоваться формулой:
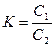
Если рассчитанный коэффициент распределения оказывается неодинаковым для всех взятых концентраций, то расчет величины К необходимо провести графически.
Величины n и К можно найти, построив график зависимости lgС1 от lgС2. Тангенс наклона прямой к оси абсцисс дает значение n, а отрезок, отсекаемый прямой по оси ординат – величину коэффициента распределения lgК.
Пример расчета. На титрование исходного раствора (2 мл) уксусной кислоты было затрачено 4,9 мл 0,1 н раствора щелочи.
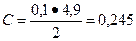
После экстрагирования на титрование 2 мл уксусной кислоты было затрачено 4,04 мл щелочи.
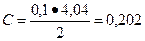
Количество кислоты, перешедшей в бензол:
С2= С-С1= 0,245 – 0,202 = 0,043
Находим логарифмы lgС1 и lgС2.
lgС1 = lg 0,202 = - 0,6946
lgС2 = lg 0,043 = - 1,3665
Аналогично находим концентрации и рассчитываем их логарифмы для растворов уксусной кислоты с другими концентрациями. Строим график зависимости lgС1 от lgС2.
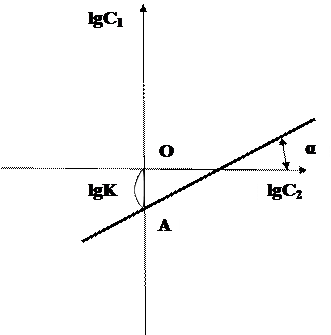
Из графика находим:
lgК =ОА=-0,19
К = ant lg-0,19= ant lg1,81=0,645
n=tg α= 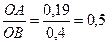
Контрольные вопросы по теме: «Адсорбция»
1. Характеристика поверхностных явлений.
2. Адсорбция газов и паров на твердых телах. Адсорбция на поверхности раздела фаз раствор - газ.
3. Поверхностные явления на границе твердое вещество – жидкость.
4. Адсорбция на твердых телах из раствора (молекулярная, ионная, ионно-обменная).
5. Методы измерения адсорбции.
6. Что такое адсорбционный гистерезис и в чем причина его возникновения?
7. В чем сущность весового и объёмного методов измерения изотерм адсорбции?
8. Как можно определить теплоту адсорбции?
9. Как классифицируют адсорбенты? Приведите примеры наиболее распространенных адсорбентов и их использования.
10. Какова роль адсорбции в хроматографии?
 2015-02-04
2015-02-04 705
705








