Две жидкости нерастворимые одна в другой, при смешивании образуют два слоя. Если к такой смеси прибавить небольшое количество вещества, растворимого в обеих жидкостях, то оно самопроизвольно распределится между двумя слоями в определенном отношении.
Изучение распределения вещества между двумя несмешивающимися растворителями позволяет найти необходимые данные для разделения различных веществ, выяснить наличие диссоциации или ассоциации растворенного вещества, получить ряд других сведений о поведении растворенного вещества.
Рассмотрение соотношения между равновесными концентрациями в каждой из жидкостей позволяет сформулировать закон распределения: отношение активностей распределяемого вещества в двух несмешивающихся растворителях при постоянной температуре есть величина постоянная, называемая коэффициентом распределения:
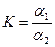
Коэффициент распределения не зависит от общей концентрации растворенного вещества в обоих растворителях, от абсолютного и относительного количества каждого из растворителей и приближенно равен отношению растворимости данного вещества в каждом из растворителей.
|
|
|
Коэффициент распределения зависит от температуры, природы распределяемого вещества и растворителей.
Если концентрации распределяемого вещества невелики, то вместо активностей можно использовать концентрации:
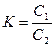
Если распределяющееся вещество ассоциировано, то применяется формула:
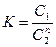
где 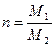 (М1 и М2 – средние молекулярные массы в первом и втором растворителях).
(М1 и М2 – средние молекулярные массы в первом и втором растворителях).
Когда распределяющееся вещество диссоциирует, применяется формула:
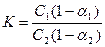
где α1 и α2- степени диссоциации вещества в соответствующих растворителях.
Добавление вещества к двум частично смешивающимся растворителям может повлиять на их взаимную растворимость. Например, если к двухслойной системе фенол-вода добавить нафталин, который в воде не растворяется, то растворимость фенола в воде уменьшается. Прибавка соли, не растворимой в феноле, уменьшает растворимость воды в феноле.
В некоторых случаях добавление соли вызывает расслаивание двух полностью смешивающихся жидкостей. Например, добавка карбоната калия расслаивает смесь этилового спирта и воды, а хлорид калия расслаивает смесь пропилового спирта и воды.
Закон распределения используется в практике извлечения (экстрагирования) растворенного вещества из раствора с помощью другого растворителя и позволяет находить наиболее выгодные условия экстрагирования. Зная величину коэффициента распределения, можно производить расчеты количества извлекаемого вещества. Чем больше коэффициент распределения, тем больше процент извлечения и эффективнее процесс экстракции.
|
|
|
Количество вещества, оставшееся в растворе после экстрагирования, рассчитывают по формуле:
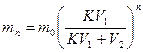
где m0 – начальное количество экстрагируемого вещества,
V1 – объем растворителя, в котором находится вещество,
V2 – объем растворителя, при помощи которого производится экстрагирование,
n – общее число экстрагирований,
m1, m2, … mn – количество вещества, остающегося в первоначальном растворе после 1, 2, 3, …, n экстрагирований,
К – коэффициент распределения.
Путем последовательного многократного извлечения некоторым количеством растворителя, поделенном на части (малыми порциями), извлечение вещества осуществляется более полно, чем всем количеством растворителя сразу.
Условно принято считать, что коэффициентом распределения обозначают отношение концентрации раствора, из которого экстрагируется распределенное вещество, к концентрации раствора, которым производится экстрагирование.
 2015-02-04
2015-02-04 2483
2483








