Буферным раствором или буфером называется раствор, рН которого остается с известной точностью постоянным несмотря на добавление небольших количеств кислоты или основания. Буферные растворы обычно готовят из смеси слабой кислоты и ее соли (или слабого основания и его соли). Например, ацетатный буфер состоит из уксусной кислоты и ее соли – ацетата натрия.
Рассмотрим механизм действия буферной смеси на примере ацетатного буфера. В растворе уксусной кислоты существует равновесие:
СН3СООН ↔ СН3СОО + Н+
Константа ее электролитической диссоциации:
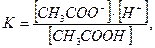 откуда (1)
откуда (1)
Значение концентрации водородных ионов:
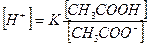 (2)
(2)
Степень электролитической диссоциации уксусной кислоты незначительна, поэтому в растворе преобладают ее недиссоциированные молекулы. Добавление к водному раствору уксусной кислоты ее натриевой соли, почти нацело распадающейся в водных растворах на составляющие ее ионы настолько понижает диссоциацию уксусной кислоты, что концентрация недиссоциированных молекул будет почти равна концентрации кислоты. Тогда концентрацию недиссоциированной кислоты можно заменить общей концентрацией кислоты в растворе:
|
|
|
[СН3СООН] = [кислота],
а концентрацию ацетатных ионов — концентрацией соли в растворе:
[СН3СОО] = [соль].
Подставив эти величины в выражение (2), получим уравнение расчёта [Н+] для буферного раствора:
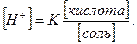 (3)
(3)
Величина К (константа электролитической диссоциации кислоты) при данных условиях постоянна. Применяя такие же рассуждения, для смеси слабого основания и соли сильной кислоты можно вывести уравнение:
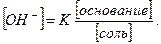
Из уравнения (3) следует, что концентрация водородных ионов буферных растворов зависит не от абсолютного значения концентрации кислоты и соли, а лишь от их соотношения. Вследствие этого при разбавлении буферных растворов концентрация водородных ионов практически не изменяется.
Действительно, если к смеси уксусной кислоты и ацетата натрия добавить соляную кислоту, то последняя вступает в обменную реакцию с ацетатом натрия, образуя хлорид натрия и освобождая слабую уксусную кислоту:
Cl- + Н+ + Na+ + СН3СОО- → Na+ + Cl- + СН3СООН.
Таким образом, буферные растворы обладают следующими свойствами:
1. Концентрация водородных ионов буферных смесей не зависит от разбавления.
2. Добавление к буферным растворам небольших количеств сильной кислоты или основания очень мало изменяет в низ концентрацию ионов водорода (в пределах буферной емкости раствора).
Предел, в котором проявляется буферное действие, называется буферной емкостью (В). Численно буферная емкость определяется количеством моль-эквивалентов сильной кислоты или основания, которое надо добавить к 1 л буферной смеси, чтобы изменить величину рН на единицу.
|
|
|
Величина буферной емкости зависит от концентрации компонентов буферной смеси и их отношения. Чем выше концентрация компонентов буферной смеси, тем больше ее емкость. Максимальное буферное действие наблюдается в случае, если кислота и соль находятся в растворе в эквивалентных количествах.
Наличие буферных смесей в живых организмах определяет постоянство рН крови, молока, клеточного сока растений. Карбонатная и фосфатная буферные системы имеют большое значение в регулировании биохимических процессов в организме, почве, в процессах пищевой промышленности.
Водные растворы характеризуются определенной концентрацией водородных ионов, зависящей от содержащихся в них веществ.
Методы определения рН растворов и биологических жидкостей делятся на две группы:
1. Колориметрические, или непрямые, методы.
2. Электрометрические, или прямые, методы.
Из этих методов наиболее простыми и распространенными являются колориметрические методы определения рН, основанные на свойстве кислотных и основных индикаторов изменять свою окраску в зависимости от активности ионов водорода (рН) в растворе.
Индикаторы колориметрии обычно представляют собой слабые органические кислоты или основания с различной окраской недиссоциированных молекул и соответствующих анионов или катионов. Например, молекулы метилового оранжевого окрашены в желтый цвет(щелочная среда), а отвечающие ему катионы - в красный (кислая среда). Границы рН, в которых меняется окраска индикатора, называется интервалом перехода. На практике, для точного определения рН, могут быть применены только такие индикаторы, которые дают промежуточные окраски между окраской в кислой и щелочной среде, например, различные оттенки оранжевого цвета у метилоранжа.
Изменение окраски, или, точнее, переход от «кислой» окраски к «щелочной» происходит у различных индикаторов при разных концентрациях водородных ионов в зависимости от константы диссоциации каждого индикатора. Поэтому можно подобрать соответствующие индикаторы и составить из них для растворов с точно измеренным значением рН целую шкалу окрасок. При помощи такой шкалы путем сравнения ее с окраской исследуемого раствора, обработанного соответствующим индикатором, можно определить концентрацию водородных ионов и соответственно рН.
В настоящее время для быстрого приближенного определения рН растворов применяют универсальный индикатор (или универсальную индикаторную бумагу), который представляет собой смеси индикаторов с разными, но примыкающими друг к другу интервалами перехода окраски. Этот метод даёт точность 0,5-1,0 рН. Обычно зона перехода окраски индикатора лежит в пределах двух единиц рH, т.е. на единицу выше и на единицу ниже точки перехода:
Сущность колориметрического метода определения рН заключается в сравнении окраски индикатора в исследуемом растворе с окраской индикатора в стандартном растворе, т. е., растворе с известной величиной рН.
Следовательно, кроме индикатора необходимо иметь ряд стандартных растворов с определенной и практически неизменной величиной рН. Обычно для этой цели пользуются буферными растворами, но существуют и безбуферные стандартные растворы.
Колориметрический метод позволяет просто, удобно, быстро – даже в полевых условиях – определить рН среды. Точность его - (0,1 единицы рН); не всегда считается достаточной наличие в растворе значительного количества солей, белков и пр. может привести к некоторым ошибкам. Мало пригоден метод в случае мутных и окрашенных жидкостей.
Вопросы для подготовки и контроля знаний
1. Ионное произведение воды. Водородный показатель.
2. Буферные растворы. Буферная ёмкость раствора.
|
|
|
3. Расчеты рН буферных растворов.
4. Приведите примеры буферных смесей.
5. Как можно увеличить буферную емкость буферной смеси?
6. Как измениться рН и буферная емкость раствора при увеличении в одинаковой мере концентрации соли и кислоты.
7. Что такое величина рН?
8. Какова сущность колориметрического метода определения рН?
9. Границы изменения рН?
10. Какие вещества называются индикаторами, какова их особенность?
11. Что такое универсальный индикатор?
12. Какую роль играют буферные смеси в данном методе определения рН?
13. Достоинства и недостатки колориметрического метода?
 2015-02-04
2015-02-04 2054
2054
