Таблица 1
Международная система единиц СИ.
| Символ | Название величины | Единицы измерения в системе СИ | Другие единицы измерения | Коэффициент пересчета |
| F | Сила | Ньютон, Н | дин | 10-5 |
| P | Вес | Килограмм, кг | г | 10-3 |
| m | Масса | Килограмм, кг | г | 10-3 |
| l | Длина | Метр, м | см | 10-2 |
| τ | Время | Секунда, с | с | |
| A | Атомная масса | г/моль | г/моль | |
| M | Молекулярная масса | г/моль | г/моль | |
| V | Объем | Кубический метр, м3 | л | 10-3 |
| M | Молярность, молярная концентрация | Киломоль/кубический метр, кмоль/м3 | моль/л | |
| M | Моляльность, молярная концентрация | Киломоль/килограмм, кмоль/кг | моль/1000 г | 10-3 |
| V | Разбавление | Кубический метр/киломоль, м3/кмоль | л/моль | |
| P | Давление | Ньютон/квадратный метр, н/м2 | мм рт. ст. | 1,333•102 |
| πосм | Осмотическое давление | Ньютон/квадратный метр, н/м2 | атм. | 1,0133•105 |
| ρ | Плотность | Килограмм/кубический метр, кг/м3 | г/см3 | 103 |
| A | Работа, производимая истемой | Джоуль/киломоль, Дж/кмоль | л-атм/моль | 1,0133•105 |
| E | Энергия | Джоуль, Дж | эрг | 10-7 |
| Q | Теплота | Джоуль, Дж | кал | 4,187 |
| H | Энтальпия | Джоуль/киломоль, Дж/кмоль | Ккал/моль | 4,187•105 |
| S | Энтропия | Джоуль/град, Дж/град | Кал/град | 4,187 |
| C | Теплоемкость | Джоуль/киломоль, Дж/кмоль | кал/моль•град | 4,187•105 |
| T | Температура | Градусы, град | °C | +273,15 |
| U | Внутренняя энергия | Джоуль/киломоль, Дж/кмоль | Ккал/моль | 4,187•105 |
| K | Криоскопическая константа | 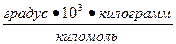 , , 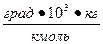 | град•103г/моль | |
| E | Эбуллиоскопическая константа | 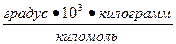 , , 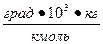 | град•103г/моль | |
| φ | Электродный потенциал | Вольт, В | В | |
| E | Электродвижущая сила | Вольт, В | В | |
| η | Вязкость | 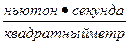 , , 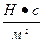 | см | 10-3 |
| σ | Поверхностное натяжение | Ньютон/метр. Н/м | дин/см | 10-3 |
Таблица 2
Стандартные термодинамические величины
некоторых веществ
| Вещество | D H °, кДж/моль | S °, Дж/моль×К | D G °, кДж/моль |
| Al2O3 (к) | 1676.0 | 50.9 | 1582.0 |
| CuO (к) | - 162.0 | 42.6 | - 129.9 |
| FeO (к) | - 264.8 | 60.8 | - 244.3 |
| Fe2O3 (к) | - 822.2 | 87.4 | - 740.3 |
| CaO (к) | - 635.5 | 39.7 | - 604.2 |
| CH4 (г) | - 74.9 | 186.2 | - 50.8 |
| C2H5OH (ж) | - 277.6 | 160.7 | - 174.8 |
| CO2 (г) | - 393.5 | 213.7 | - 394.4 |
| H2 (г) | 130.5 | ||
| HCl (г) | - 92.3 | 186.8 | - 95.2 |
| O2 (г) | 205.0 | ||
| H2O (ж) | - 285.8 | 70.1 | - 237.3 |
| H2O (г) | - 241.8 | 188.8 | - 228.6 |
| H2O (к) | -292 | ||
| CH3COOH (ж) | - 484.5 | 159.8 | - 389.9 |
| Cl2 (г) | 223.1 |
Таблица 3
Стандартная энтальпия образования некоторых веществ.
| вещество | D H ° | вещество | D H ° | ||
| кДж/моль | ккал/моль | кДж/моль | ккал/моль | ||
| C2H2 (г) | +226,8 | 54,2 | Н2S (г) | -20,9 | -5,0 |
| CO (г) | -110,5 | -26,4 | MgO (к) | -601,6 | -143,8 |
| CaСO3 (к) | -1205,0 | -288,0 | NH3 (г) | -46.0 | -11.0 |
| Ca(FeO)2(к) | -1665,2 | -398,0 | NO (г) | +90.3 | +21.6 |
| Cu2O (к) | -166,5 | -39,8 | NO2 (г) | +33.9 | +8.1 |
| Cu2S (к) | -82,0 | -19,6 | N2O4 (г) | +9.2 | +2.2 |
Таблица 4
Важнейшие физические константы.
| Величина | Численные значения, формулы |
| Универсальная газовая постоянная, R Постоянная Фарадея, F Электрохимический эквивалент, К э Число Авогадро, Nа | 8,314 Дж/моль×К 1,987 кал/ моль×К 0,082 л×атм/ моль×К 62,36 л×мм рт.ст./ моль×К 96500 кул/моль 26,8 А×час К э = А / z × F 6,024•1026 моль- |

Таблица 5
Константы диссоциации слабых электролитов при 250 С
| Электролит | Уравнение диссоциации | К |
| Азотистая кислота | HNO2↔ H+ + NO2- | 4,0•10-4 |
| Гидроксид аммония | NH4OH↔NH4++OH- | 1,79•10-5 |
| Вода | H2O↔H++OH2- | 1,8•10-16 |
| Угольная кислота | H2CO3↔H++HCO3- HCO3-↔H++CO32- | 4,3•10-7 5,6•10-11 |
| Фосфорная кислота | H3PO4↔H++H2PO4- H2PO4-↔H++HPO42- HPO42-↔H++PO43- | 7,5•10-3 6,2•10-8 2,2•10-13 |
| Фтористоводородная кислота | HF↔H++F | 7,4•10-4 |
| Цианистоводородная кислота | HCN↔H++CN- | 7,2•10-10 |
| Уксусная кислота | CH3COOH↔CH3COO-+H+ | 1,87•10-5 |
Таблица 6
Стандартные потенциалы
| Полуреакция | Е0, В | ||
| Ag+ + e = Ag AgBrO3 + e = Ag + BrO3- Al3+ + 3e = Al H3AsO4 +2H+ + 2e = HAsO2 + 2H2O BF4- + 3e = B + 4F- Br2 + 2e = 2Br- BrO- + H2O + 2e = Br- + 2OH- BrO3- +6H+ +6e = Br- +3H2O CH3COOH + 2H+ + 2e = CH3CHO 2CO2 + 2H+ = H2C2O2 Cd2+ +2e = Cd Cl2 + 2e = 2Cl- 2ClO3- + 12H+ + 10e = Cl2 + 6H2O Cr2O72- +14H+ +6e = 2Cr3+ +7H2O Cr3+ + e = Cr2+ Cu2+ + e = Cu+ Cu2+ + 2e = Cu Fe3+ + e = Fe2+ Fe2+ + 2e= Fe HBrO + H+ + 2e = Br- + H2O 2H+ +2e = H2 H2O2 + 2H+ + 2e = 2H2O НСОО- + 2H2O + 2e = НСНО + 3OH- 2H2SO3 + 2H+ + 4e = S2O32- + 3H2O Hg2+ + 2e = Hg Hg22+ + 2e = Hg | 0,80 0,55 -1,66 0,56 -1,04 1,09 0,76 1,45 -0,12 -0,49 -0,40 1,36 1,47 1,33 -0,41 0,15 0,34 0,77 -0,44 1,34 0,00 1,77 -1,07 0,40 0,85 0,79 | ||
| 2Hg2+ +2e = Hg22+ Hg(CN)42- + 2e = Hg + 4CN- I2 + 2e = 2I- I3- + 3e = 3I- 2ICL3 +6e = I2 + 6Cl- IO3- + 5H+ + 4e = HIO + 2H2O IO3- + 4H+ + 4e = IO- + 2H2O MnO4- +4H+ +3e = MnO2 + 2H2O MnO4- +8H+ +5e = Mn2+ + 4H2O MnO4- +2H2O +3e = MnO2 + 4OH- Mn(OH)2 + 2e = Mn + 2OH- MnO2 + 4H+ + 2e = Mn2+ + 2H2O NO2- +2H+ +e = NO + H2O NO3- + 4H+ + 3e = NO + 2H2O NO3- + H2O + 2e = NO2- + 2OH- NO3- + 3H+ + 2e = HNO2 + H2О Ni2+ + 2e = Ni Pb2+ +2e = Pb S +2e = S2- S +2H+ + 2e = H2S SO42- + 4H+ + 2e = H2SO3 + H2O S4O62- + 2e = 2S2O32- Sn4+ +2e = Sn2+ TiO2+ + 2H+ + e = Ti3+ + H2O TiF62- +4e = Ti + 6F- Tl3+ + 2e = Tl+1 | 0,91 -0,37 0,62 0,55 1,28 1,14 0,97 1,69 1,51 0,60 -1,18 1,23 1,20 0,96 0,01 0,94 -0,23 -0,13 -0,48 0,14 0,17 0,09 0,15 0,1 -1,19 1,28 | ||
| UO2+ + 4H+ + e = U4+ + 2H2O V3+ + e = V2+ VO2+ +2H+ + e = V3+ + H2O VO2+ + 4H+ + 2e = V3+ + 2H2O VO43- + 6H+ + 2e = VO+ +3H2O Zn2+ + 2e = Zn | 0,55 -0,26 0,34 0,67 1,26 -0,76 | ||
Таблица 7
Значение водородного показателя рН буферных смесей.
Отношение концентраций 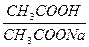 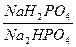 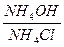 | рН буферных смесей | ||
| ацетатная | фосфатная | аммонийная | |
| 9:1 | 3,72 | 5,91 | 10,28 |
| 8:2 | 4,05 | 6,24 | 9,95 |
| 7:3 | 4,27 | 6,47 | 9,73 |
| 6:4 | 4,45 | 6,64 | 9,55 |
| 5:5 | 4,63 | 6,81 | 9,37 |
| 4:6 | 4,80 | 6,98 | 9,20 |
| 3:7 | 4,99 | 7,17 | 9,01 |
| 2:8 | 5,23 | 7,38 | 8,77 |
| 1:9 | 5,57 | 7,73 | 8,43 |
ПРАВИЛА ПОЛЬЗОВАНИЯ ТАБЛИЦАМИ ДЕСЯТИЧНЫХ ЛОГАРИФМОВ.
Десятичный логарифм – показатель степени, в который нужно возвести основание, т.е. число 10, чтобы получить данное число.
Например: lg 100 = 2, т.к. 102= 100, где число 2 – показатель степени.
lg 10 = 1, т.к. 101= 10
lg 1=0. т.к. 100= 1
Логарифмы чисел < 1 отрицательны.
lg 0,001 = lg 10-3, т.к. 10-3= 0,001
Логарифмы чисел, состоящих из единицы с нулями, равны числу нулей (т.е. lg 10=1; lg 100=2; lg 1000=3 и т.д.). Логарифмы десятичных дробей, состоящих из единицы с предшествующими ей нулями, равны числу нулей, взятому со знаком минус (т.е. lg 0,1= -1; lg 0,01= -2; lg 0,001= -3 и т.д.). Логарифмы отрицательных чисел состоят из целого числа - характеристики и дробной части – мантиссы.
lg 857 = 2,9330 lg 0,247 = ˉ1,3927
lg 12,74 = 1,1052 lg 0,035918= ˉ2,5541
(знак минус относится к характеристике)
По логарифму можно найти число:
lg х = 0,1759 х = 1,499
lg х= 3,4528 х = 2836
lg х=ˉ4,0820 х =0,0001208
При нахождении числа по отрицательному логарифму, нужно к характеристике прибавить единицу, поменять знак ее на обратный, первые три цифры вычесть из 9, а четвертую - из 10.
Например:
lg х= -1,7415 = ˉ2,2585(-2+0,2585 = 1,7415)
х = 0,01813
lg ab = lg a + lg b lg a/b = lg a - lg b
lg ab = b lg a lg b√a = (lg a)/b
Значения в математических таблицах десятичных логарифмов иногда бывают точными, но чаще приближенные, т.к. представляют собой результаты округления точных значений и содержат погрешности, не превосходящие половины единицы разряда последней цифры.
При вычислении посредством таблиц необходимо соблюдать следующие правила:
1. Мантисса десятичного логарифма любого трехзначного числа отыскивается по таблице десятичных логарифмов на строке, номер которой образуют две значащие цифры этого числа, в столбце, номер которого совпадает с третьей его цифрой. Интерполяция на четвертую цифру числа дает поправку, помещенную на той же строке в соответствующем столбце справа (курсив). Поправка прибавляется к табличной мантиссе. Например, мантисса логарифма числа 3174 равна 5011+6=5017.
2. Подобным же образом по таблице определяется число по данной мантиссе его логарифма. Например, имея мантиссу 8352, получаем число 6839+3=6842, в котором положение знака дробности устанавливается по характеристике.
5. Методические указания по выполнению самостоятельной работы
Министерство сельского хозяйства Российской Федерации
Департамент кадровой политики и образования
Федеральное государственное образовательное учреждение
высшего профессионального образования
«Мичуринский государственный аграрный университет»
 2015-02-04
2015-02-04 994
994








