Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем, и зависит от концентрации раствора. Понижение давления пара над растворителем приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
∆tз = tз растворителя – tз раствора;
∆tзам – понижение температуры замерзания раствора по сравнению с чистым растворителем (температурная депрессия)
Криоскопия -это метод исследования растворенных веществ путем измерения температуры замерзания растворителя и приготовленного на его основе раствора. Криоскопический метод позволяет определить молярную массу растворенного вещества. В основе метода криоскопии лежит математическое выражение II закона Рауля: «Понижение температуры замерзания раствора по отношению к чистому растворителю прямопропорционально моляльной концентрации вещества», которое отражает следующая формула (для растворов неэлектролитов):
∆tзам = КСm, где
К – коэффициент пропорциональности, называемый криоскопической константой.
Численно криоскопическая константа равна понижению температуры замерзания раствора с концентрацией 1 моль на 1000 г растворителя по сравнению с чистым растворителем. Криоскопическая константа воды равна 1,86°С/моль, для бензола 5,1°С/моль, для нафталина 7,1°С/моль, уксусной кислоты 3,9°С/моль. Криоскопическая константа не зависит от концентрации и природы растворенного вещества, а обусловлена лишь природой растворителя.
Сm – моляльная концентрация раствора, которая может быть рассчитана найдена по формуле:
Сm 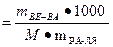 , где
, где
mве-ва – навеска растворенного вещества в граммах,
mра-ля – масса взятого растворителя,
М – молярная масса растворенного вещества.
Пользуясь основной формулой криоскопии, можно найти любую из входящих в нее величин, если измерены или известны остальные. При определении молярной массы эта формула принимает вид:
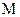
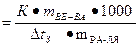
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся: понижение давления пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотической давление.
Если растворенное вещество – электролит, то число частиц, находящихся в растворе, будет больше числа молекул за счет их диссоциации. Это приводит к большему понижению упругости пара, а понижение температуры замерзания окажется больше того, которое отвечает имеющейся моляльной концентрации, а найденная молярная масса (кажущаяся) окажется меньше истинной.
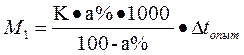 ,
,
где а – массовая доля вещества в растворе; К- криоскопическая константа: ∆ tопыт - понижение температуры в опыте.
Посчитав по химической формуле электролита истинную молярную массу, легко найти степень диссоциации:
α= 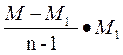 ,
,
где М – истинная молярная масса; М1 – кажущаяся молярная масса.
Степень диссоциации может быть найдена по другой формуле:
α= 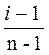 ,
,
гдеi - коэффициент Вант-Гоффа;
n - число ионов, на которое подвергается распаду молекула электролита.
Законы Рауля и Вант-Гоффа можно применять к растворам электролитов с учетом так называемого изотонического коэффициента (i), который показывает, во сколько раз число частиц (молекул и ионов), образовавшихся в результате диссоциации, больше исходного числа молекул. Так как i>1, формулы, выражающие свойства растворов электролитов, примут следующий вид:
∆tзам = iКСm
i = 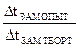 =
= 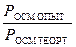 =
= 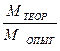
Если известна процентная концентрация исследуемого раствора, то ∆tзам находят по формуле:
∆tзам теор = 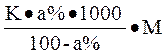
∆tоп находят практически, как разность температур замерзания растворителя и раствора:
∆tоп= ∆tзам ра-ля - ∆tзам ра-ра
Осмотическое давление. Непосредственное определение осмотического давления по закону Вант-Гоффа представляет ряд неудобств и трудностей:
РОСМ= СRТ,
где С – молярная концентрация раствора; Р - осмотическое давление раствора; R – газовая постоянная; Т – температура раствора.
Поэтому осмотическое давление находят косвенно методом криоскопии.Между осмотическим давлением и понижением температуры замерзания соответствующего раствора существует простое численное соотношение:
Р = 12,04 ∆t зам,
где Р – осмотическое давление при температуре 0°С,
∆t зам – измеренное понижение температуры замерзания.
РОСМ= 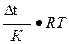
Вопросы для подготовки и контроля знаний
16. Механизм растворения. Термодинамика процесса растворения.
17. Способы выражения концентраций растворов.
18. Идеальные растворы. Закон Рауля.
19. Давление насыщенного пара растворителя над раствором.
20. Температура замерзания и кипения разбавленных растворов.
21. Криоскопия и эбуллиоскопия.
22. Осмос и осмотическое давление. Закон Вант-Гоффа.
23. Роль осмоса в биологических процессах. Растворы изотонические, гипертонические, гипотонические.
24. Почему в скороварке в которой при нагревании возникает повышенное давление время приготовления пищи сокращается?
25. При приготовлении варенья в домашних условиях используют очень высокие концентрации сахара. Это, в частности, приводят к уничтожению бактерий, вызывающих ботулизм. Объясните этот эффект.
26. Теория электролитической диссоциации. Изотонический коэффициент, его связь со степенью диссоциации.
27. Закон разбавления Оствальда..
28. Что такое осмотическое давление?
29. В результате какого процесса происходит засахаривание варенья?
30. Опишите осмотические процессы, происходящие при заваривании пакетированного чая.
 2015-02-04
2015-02-04 2419
2419
