Введём теперь новый параметр состояния теромдинамической системы – энтропию, который принципиально отличается от других параметров состояния направленностью своего изменения. Элементарное изменение энтропии определяется как соотношение бесконечно малого количества теплоты, сообщённого термодинамической системе в обратимом процессе, к её температуре:
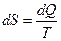 . .
| (9.36) |
Использовав формулу (9.36), запишем выражение первого начала термодинамики (9.3) в виде
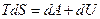 . .
|
и проинтегрируем его при условии T=const.
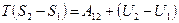 . .
|
или
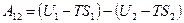 . .
|
Обозначим
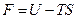 , ,
| (9.37) |
тогда
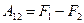 ; ;
| (9.38) |
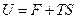 . .
| (9.39) |
Величина F носит название свободной энергии термодинамической системы, а TS – связанной энергии. Из (9.39) видно, что внутреннюю энергию можно представить как сумму свободной и связанной энергий. Свободная энергия – это та часть внутренней энергии, которая может быть превращена в работу при постоянной температуре. Связанная энергия представляет ту часть энергии, которая не может быть превращена в работу. При данной температуре связанная энергия пропорциональна энтропии, поэтому можно сказать, что энтропия есть мера связанной энергии термодинамической системы.
Рассмотрим теперь понятия свободной и связанной энергии, а также энтропии с точки зрения молекулярно-кинетической теории на примере простейшей термодинамической системы – идеального газа.
Внутренняя энергия идеального газа, как уже было отмечено, представляет собой суммарную кинетическую энергию хаотического движения молекул. Если система выполняет работу, то часть энергии хаотического движения преобразуется в энергию направленного движения. Поэтому можно сказать, что свободная энергия – это та часть энергии хаотического движения, которая может быть преобразована в энергию направленного движения при постоянной температуре.
Связанная энергия – это та часть энергии хаотического движения, которая не может быть преобразована в энергию направленного движения. При этом, чем больше энтропия, тем большую часть хаотического движения нельзя превратить в энергию направленного движения. Поэтому можно сказать, что энтропия есть мера хаотичности системы.
Рассмотрим теперь изменение энтропии для некоторых обратимых процессов в идеальном газе. Адиабатный процесс. Для такого процесса 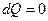 , следовательно,
, следовательно, 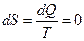 или (после интегрирования)
или (после интегрирования)
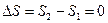 . .
| (9.40) |
Из (9.40) видно, что при адиабатном процессе энтропия остается величиной постоянной, поэтому такой процесс называют изоэнтропийным.
1. Изотермический процесс. В изотермическом процессе 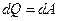 или
или 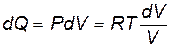 , поэтому
, поэтому 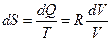 .
.
Интегрируя последнее выражение, получаем
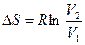 , ,
| (9.41) |
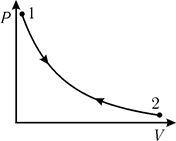 Рис. 9.9
Рис. 9.9
|
т.е. при обратимом изотермическом процессе расширения энтропия возрастает, а при сжатии убывает.
Для обратимого цикла, основанного на изотермическом процессе (1®2®1, рис. 9.9) суммарное изменение энтропии
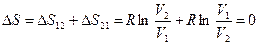 , ,
| (9.42) |
т.е. для обратимого изотермического цикла изменение энтропии равно нулю.
2. Цикл Карно. Изменение энтропии в цикле Карно определяется суммой ее изменений на каждом из участков (см. рис. 9.8):
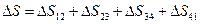 .
.
Поскольку процессы 2®3 и 4®1 адиабатные, то на основании (9.40) 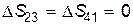 , поэтому
, поэтому
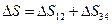 . .
| (9.43) |
Используя выражение (9.41) для изменения энтропии в изотермическом процессе, из (9.43) получим
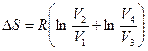
или
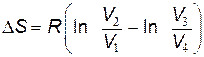 .
.
Есть учесть условие замкнутости цикла (9.32), то из последнего выражения следует, что изменение энтропии в цикле Карно
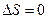 . .
| (9.44) |
 Рис. 9.10
Рис. 9.10
|
На основании (9.40), (9.42) и (9.44) и анализа других процессов можно сделать общий вывод: в обратимых циклических процессах энтропия остается постоянной.
Проанализируем изменение энтропии в необратимых процессах. Как пример, рассмотрим процесс теплопередачи (рис. 9.10). Поскольку 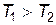 , то теплопередача происходит в направлении от первого тела ко второму. Элементарное изменение энтропии первого тела
, то теплопередача происходит в направлении от первого тела ко второму. Элементарное изменение энтропии первого тела
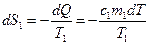 ,
,
где с1 – удельная теплоемкость тела 1. Знак "–" подтверждает, что теплота отдается горячим телом холодному.
Аналогично изменение энтропии второго тела
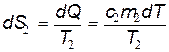 .
.
Изменение энтропии всей системы
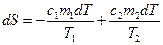
или
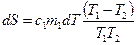 .
.
при этом использовано то, что количество теплоты 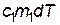 , отданное первым телом, равно количеству теплоты
, отданное первым телом, равно количеству теплоты 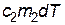 , полученному вторым телом. Поскольку
, полученному вторым телом. Поскольку 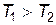 , то из последнего соотношения видно, что процесс теплопередачи сопровождается ростом энтропии:
, то из последнего соотношения видно, что процесс теплопередачи сопровождается ростом энтропии:
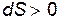 . .
| (9.45) |
Соотношение (9.45) справедливо не только для процессов теплопередачи. Можно показать, что оно выполняется для любого необратимого процесса. Таким образом, в замкнутых системах необратимые процессы протекают в таком направлении, которое ведет к возрастанию энтропии системы:
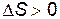 . .
| (9.46) |
Объединяя результаты, полученные для обратимых и необратимых процессов, можно сформулировать второе начало термодинамики в виде
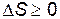 , ,
| (9.47) |
т.е. в замкнутых системах могут протекать лишь такие процессы, при которых энтропия системы не убывает (т.е. растет до некоторого максимального значения или остается постоянной).
 2015-02-04
2015-02-04 662
662








