Рассмотренные выше изотермический и адиабатический процессы изменения состояния газа являются идеализированными процессами: первый из них требует идеального контакта с окружающей средой или с термостатом, второй – столь же идеальной изоляции. Оба эти процесса можно рассматривать как частные крайние случаи более общего процесса, называемого политропическим. Так называется всякий процесс изменения состояния, при котором теплоемкость C остается постоянной и равной
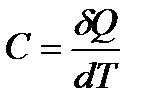 , или δQ = CdT.
, или δQ = CdT.
Кривая, изображающая политропический процесс, называется политропой. Если обозначить молярную теплоемкость идеального газа в политропическом процессе через C, то уравнение политропы записывается как pVn = const или TVn–1 = const,
где
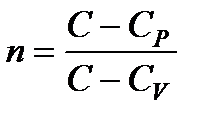 . (124)
. (124)
Постоянная n называется показателем политропы.
Для изотермического процесса C = ∞. Подставляя это значение в уравнение (124), получаем n = 1. Согласно уравнению TVn–1 = const получаем T = const.
Для адиабатического процесса C = 0. Согласно (124) 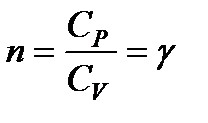 . Тогда уравнение pVn = const превращается в уравнение адиабаты pVγ = const.
. Тогда уравнение pVn = const превращается в уравнение адиабаты pVγ = const.
Теплоемкости реальных газов зависят от состояния. Однако у идеального газа теплоемкости те зависят от состояния. Поэтому можно вычислить показатель политропы для изобарического и изохорического процессов.
Для изобарического процесса C = CP и n = 0. Согласно уравнению pVn = const получаем P = const.
Для изохорического процесса C = CV и n = ∞. Вычислим из уравнения PVn = const корень n –й степени 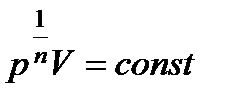 и подставим значение n = ∞. Тогда получим V = const.
и подставим значение n = ∞. Тогда получим V = const.
 2015-02-15
2015-02-15 2082
2082








