При конденсации тепло, затраченное при испарении, отдается обратно: образующаяся при конденсации жидкость (или твердое тело) нагревается.
Произведем оценку теплоты испарения жидкости. При испарении некоторого количества жидкости переходящие в газообразную фазу молекулы должны совершить работу против сил, действующих в поверхностном слое. Эти силы действуют на пути, равном толщине слоя r. Обозначив среднюю величину силы на этом пути f, а число молекул в единице массы через п', работу против сил, действующих в поверхностном слое, можно представить в виде n'fr. Процесс испарения сопровождается увеличением объема вещества, вследствие чего сопряжен с необходимостью совершения работы против внешних сил. Если, испарение происходит при постоянном внешнем давлении р, работа против внешних сил равна p(V'n — V' ж), где V'n и V' ж — удельные объемы пара и жидкости. Обе указанные выше работы совершаются за счет теплоты испарения q. Таким образом,
q = n'fr + p(V'n — V' ж). (150)
Как следует из выражения (150), теплота испарения уменьшается с температурой. В самом деле, с повышением температуры плотность насыщенного пара растет, что приводит к уменьшению сил, действующих на молекулу в поверхностном слое. Уменьшается также различие в удельных объемах насыщенного пара и жидкости. Следовательно, при повышении температуры оба слагаемых в (150) убывают. При критической температуре теплота испарения обращается в нуль.

Рис. 44. Равновесие между жидкостью и паром
Рассмотрим процесс установления равновесия между жидкостью и ее паром. Возьмем герметичный сосуд, частично заполненный жидкостью (рис. 44), и допустим, что первоначально из пространства над жидкостью вещество было полностью удалено. Вследствие процесса испарения пространство над жидкостью станет наполняться молекулами. Молекулы, перешедшие в газообразную фазу, двигаясь хаотически, ударяются о поверхность жидкости, причем часть таких ударов будет сопровождаться переходом молекул в жидкую фазу. Количество молекул, переходящих в единицу времени в жидкую фазу, очевидно, пропорционально количеству ударяющихся о поверхность молекул, которое, в свою очередь пропорционально nv, т. е. растет с давлением р. Следовательно, наряду с испарением протекает обратный процесс перехода молекул из газообразной в жидкую фазу, причем интенсивность его растет по мере увеличения плотности молекул в пространстве над жидкостью. При достижении некоторого, вполне определенного (для данной температуры) давления количества молекул, покидающих жидкость и возвращающихся в нее, станут равны. Начиная с этого момента, плотность пара перестает изменяться. Между жидкостью и паром установится подвижное равновесие (рис. 44), которое будет существовать до тех пор, пока не изменится объем или температура системы.
Давление, соответствующее подвижному равновесию, есть давление насыщенных паров рнп. Если увеличить объем сосуда, давление пара упадет и равновесие будет нарушено. В результате превратится в пар дополнительное количество жидкости, такое, чтобы давление снова стало равно рнп.. Аналогично уменьшение объема приведет к превращению некоторого количества пара в жидкость.
Количество молекул, покидающих жидкость в единицу времени, сильно растет с температурой. Количество молекул, ударяющихся о поверхность жидкости, зависит от температуры в меньшей степени (через v как 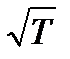 ). Поэтому при повышении температуры равновесие между фазами нарушается и в течение некоторого времени поток молекул в направлении жидкость –> пар будет превышать поток в направлении пар –> жидкость. Это продолжается до тех пор, пока возрастание давления не приведет снова к установлению подвижного равновесия. Таким образом, давление, при котором устанавливается подвижное равновесие между жидкостью и паром, т. е. давление насыщенных паров, оказывается зависящим от температуры. Вид этой зависимости показан на рис. 13.
). Поэтому при повышении температуры равновесие между фазами нарушается и в течение некоторого времени поток молекул в направлении жидкость –> пар будет превышать поток в направлении пар –> жидкость. Это продолжается до тех пор, пока возрастание давления не приведет снова к установлению подвижного равновесия. Таким образом, давление, при котором устанавливается подвижное равновесие между жидкостью и паром, т. е. давление насыщенных паров, оказывается зависящим от температуры. Вид этой зависимости показан на рис. 13.
 2015-02-15
2015-02-15 442
442







