Итак, две любые фазы вещества могут находиться в равновесии лишь при определенном давлении, величина которого зависит от температуры. Общий вид этой зависимости можно получить с помощью второго начала термодинамики. Для этого рассмотрим цикл Карно для системы, состоящей на находящихся в равновесии двух фаз данного вещества.
Для двухфазной системы цикл Карно на диаграмме (р, V) имеет вид, показанный на рис. 46 (температуры нагревателя и холодильника предполагаются отличающимися на очень малую величину Δ T). Цифрами 1 и 2 помечены крайние точки горизонтального участка изотермы с температурой Т. Состояния 1 и 2 являются однофазными состояниями. Все промежуточные точки отрезка 1 — 2 изображают двухфазные состояния, отличающиеся друг от друга распределением массы вещества между первой и второй фазой.
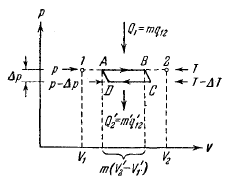
Рис. 46. К выводу уравнения Клапейрона-Клаузиуса
Изотермический процесс А —> В сопровождается фазовым превращением некоторой массы вещества т. При этом объем вещества получает приращение, равное т(V'2 — V'1), где V'1 и V'2 —удельные объемы первой и второй фаз. Для того чтобы такое превращение могло произойти, веществу нужно сообщить количество тепла Q1, равное mq12, где q12 — удельная теплота, поглощаемая при переходе из состояния 1 в состояние 2 при температуре Т. Тепло Q1 представляет собой то тепло, которое получает система в ходе цикла от нагревателя. Холодильнику тепло отдается в ходе изотермического процесса C –> D. Количество отданного тепла равно Q'2 = m'q12', где q12' — теплота перехода 1 — > 2 при температуре Т – ΔT, a m' – количество вещества, претерпевающее фазовое превращение в ходе процесса C—>D. Это количество вещества несколько отличается от т, так как некоторая масса вещества претерпевает фазовые превращения в ходе адиабатических процессов.
Работа А, совершаемая за цикл, численно равна площади цикла. Поэтому можно написать, что
A ≈ т(V'2 — V'1)Δp. (151)
Равенство (151) является приближенным. В пределе при Δр, стремящемся к нулю (для чего необходимо, чтобы ΔT стремилось к нулю), выражение (151) превращается в строгое равенство.
К. п. д. цикла по определению равен
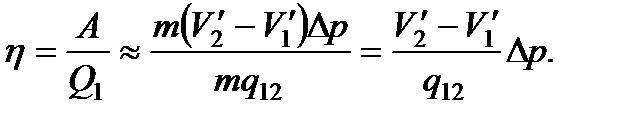 (152)
(152)
Вместе с тем
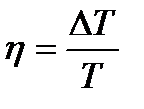 .
.
Отсюда
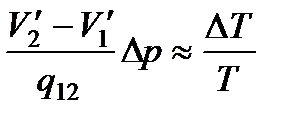 ,
,
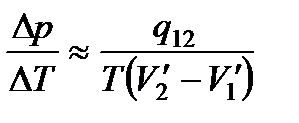 . (153)
. (153)
В пределе при ΔT –> 0 приближенное равенство (153) превращается в строгое равенство:
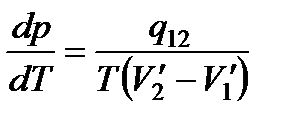 . (154)
. (154)
Соотношение (154) называется уравнением Клапейрона — Клаузиуса. Уравнение Клапейрона—Клаузиуса связывает производную от равновесного давления по температуре с теплотой перехода, температурой и разностью удельных объемов фаз, находящихся в равновесии.
Согласно (154) знак производной dp/dT зависит от того, каким изменением объема — возрастанием или уменьшением — сопровождается фазовый переход, происходящий при поглощении тепла. При испарении жидкости или твердого тела объем всегда возрастает, поэтому dp/dT для кривой испарения, а также для кривой сублимации может быть только положительной: повышение температуры приводит к увеличению равновесного давления.
При плавлении объем, как правило, возрастает, так что dp/dT >0: увеличение давления приводит к повышению температуры плавления. Однако у некоторых веществ, к числу которых принадлежит и вода, объем жидкой фазы меньше объема твердой фазы (V'2 — V'1). В этом случае dp/dT <0 — увеличение давления сопровождается понижением температуры плавления.
Известно, что вода при замерзании увеличивается в объеме. По этой причине лед имеет меньшую плотность, чем вода. Подвергнув лед сильному сжатию, можно, не повышая температуры выше 0°С, вызвать его плавление. Именно поэтому коньки скользят по льду.
Температура перехода из одной кристаллической модификации в другую будет повышаться или понижаться с ростом давления в зависимости от того, какая из твердых фаз обладает большим удельным объемом.
 2015-02-15
2015-02-15 909
909








