1. Основные понятия и определения термодинамики
3. Уравнение состояния и термодинамический процесс
4. Теплота и работа
5. Внутренняя энергия
7. Теплоемкость газа
9. Универсальное уравнение состояния идеального газа
10. Энтропия
11. Метод исследования термодинамических процессов
12. Изопроцессы идеального газа
14. Основные положения второго закона термодинамики
15. Циклы. Прямой и обратный циклы Карно
16. Первый закон термодинамики для потока
17. Критическое давление и скорость. Сопло Лаваля
18. Дросселирование
19. Свойства реальных газов
20. Уравнения состояния реального газа
21. Понятия о водяном паре
22. Характеристики влажного воздуха
23. Циклы паротурбинных установок (ПТУ)
24. Циклы двигателей внутреннего сгорания (ДВС)
25. Циклы газотурбинных установок (ГТУ)
1. Основные понятия и определения термодинамики
Различают два принципиально различных направления использования теплоты – энергетическое и технологическое. При энергетическом использовании, теплота преобразуется в механическую работу, с помощью которой в генераторах создается электрическая энергия, удобная для передачи на расстояние. Теплоту при этом получают сжиганием топлива в котельных установках или непосредственно в двигателях внутреннего сгорания. При технологическом использовании - теплота используется для направленного изменения свойств различных тел (расплавления, затвердевания, изменения структуры, механических, физических, химических свойств).
Техническая термодинамика (т/д) рассматривает закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях.
Термодинамика базируется на двух основных законах (началах) термодинамики:
- I закон термодинамики - закон превращения и сохранения энергии;
- II закон термодинамики – ставит условия протекания и направленность макроскопических процессов в системах, состоящих из большого количества частиц.
Техническая т/д., применяя основные законы к процессам превращения теплоты в механическую работу и обратно, дает возможность разрабатывать теории тепловых двигателей, исследовать процессы, протекающие в них и т.п.
Объектом исследования является термодинамическая система, которой могут быть группа тел, тело или часть тела. То, что находится вне системы, называется окружающей средой. Т/д. система это совокупность макроскопических тел, обменивающихся энергией друг с другом и окружающей средой.
Изолированная система - т/д. система, не взаимодействующая с окружающей средой.
Адиабатная (теплоизолированная) система – система имеет адиабатную оболочку, которая исключает обмен теплотой (теплообмен) с окружающей средой.
Однородная система – система, имеющая во всех своих частях одинаковый состав и физические свойства.
Гомогенная система – однородная система по составу и физическому строению, внутри которой нет поверхностей раздела (лед, вода, газы).
Гетерогенная система – система, состоящая из нескольких гомогенных частей (фаз) с различными физическими свойствами, отделенных одна от другой видимыми поверхностями раздела (лед и вода, вода и пар).
В тепловых машинах (двигателях) механическая работа совершается с помощью рабочих тел – газ, пар.
2. Параметры состояния
Величины, которые характеризуют физическое состояние тела, называются термодинамическими параметрами состояния. Такими параметрами являются удельный объем, абсолютное давление, абсолютная температура, внутренняя энергия, энтальпия, энтропия, концентрация, теплоемкость и т.д. При отсутствии внешних силовых полей (гравитационного, электромагнитного и др.) термодинамическое состояние однофазного тела можно однозначно определить 3-мя параметрами – уд. объемом (v), температурой (Т), давлением (Р).
Удельный объем – величина, определяемая отношением объема вещества к его массе.
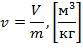 | (1.3.1) |
Плотность вещества – величина, определяемая отношением массы к объему вещества.
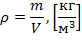 | (1.3.2) |
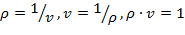 | (1.3.3) |
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
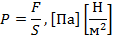 | (1.3.4) |
Внесистемные единицы давления:
1 кгс/м2 = 9,81 Па = 1 мм. водн. ст.
1 ат. (тех. атмосфера) = 1 кгс/см2 = 98,1 кПа.
1 атм. (физическая атмосфера) = 101,325 кПа = 760 мм. рт. ст.
1 ат. = 0,968 атм.
1 мм. рт. ст. = 133,32 Па.
1 бар = 0,1 МПа = 100 кПа = 105 Па.
Различают избыточное и абсолютное давление.
Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р)– давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является т/д. параметром состояния.
Абсолютное давление определяется:
- при давлении сосуда больше атмосферного:
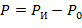 | (1.3.5) |
- при давлении сосуда меньше атмосферного:
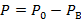 | (1.3.6) |
где Ро – атмосферное давление; Рв – давление вакуума.
Температура – характеризует степень нагретости тел, представляет собой меру средней кинетической энергии поступательного движения его молекул. Чем больше средняя скорость движения, тем выше температура тела.
За т/д. параметр состояния системы принимают термодинамическуютемпературу(Т), т.е. абсолютную температуру. Она всегда положительна, При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
3. Уравнение состояния и термодинамический процесс
Основные т/д. параметры состояния Р, υ, Т однородного тела зависят друг от друга и взаимно связаны между собой определенным математическим уравнением, который называется уравнениемсостояния:
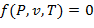 | (1.3.7) |
Равновеснымсостоянием называется состояние тела, при котором во всех его точках объема Р, υ и Т и все другие физические свойства одинаковы.
Совокупность изменений состояния т/д. системы при переходе из одного состояния в другое называется т/д. процессом. Т/д. процессы бывают равновесные и неравновесные. Если процесс проходит через равновесные состояния, то он называется равновесным. В реальных случаях все процессы являются неравновесными.
Если при любом т/д. процессе изменение параметра состояния не зависит от вида процесса, а определяется начальным и конечным состоянием, то параметры состояния называются функцией состояния. Такими параметрами являются внутренняя энергия, энтальпия, энтропия и т.д.
Интенсивные параметры – это параметры не зависящие от массы системы (давление, температура).
Аддитивные (экстенсивные) параметры – параметры, значения которых пропорциональны массе системы (объем, энергия, энтропия и т.д.).
4. Теплота и работа
Тела, участвующие при протекании т/д. процесса обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами.
1-й способ реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел либо лучистым переносом внутренней энергии излучающих тел путем э/м волн. При этом энергия передается от более нагретого тела к менее нагретому.
Количество энергии, переданной 1-м способом от одного тела к другому, называется количеством теплоты – Q [Дж], а способ – передача энергии в форме теплоты.
2-й способ связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления, То есть передачи энергии происходит при условии перемещения всего тела или его части в пространстве. При этом количество переданной энергии называется работой – L [Дж], а способ передача энергии в форме работы.
Количество энергии, полученное телом в форме работы, называется работой совершенной над телом, а отданную энергию – затраченной телом работой.
Количество теплоты, полученное (отданное) телом и работа, совершенная (затраченная) над телом, зависят от условий перехода тела из начального состояния в конечное, т.е. зависят от характера т/д. процесса.
5. Внутренняя энергия
В общем случае внутренней энергией называется совокупность всех видов энергий, заключенной в теле или системе тел. Эту энергию можно представить как сумму отдельных видов энергий: кинетической энергии молекул (поступательного и вращательного движения молекул); колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии молекул.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. При этом знание абсолютных значений внутренней энергии не требуется. Поэтому внутренней энергией для идеальных газов называют кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов дополнительно включают потенциальную энергию молекул.
Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (P,T), U = f (υ,T) U= f (P,υ). Каждому состоянию рабочего тела (системы) соответствует вполне определенное значение параметров состояния, то для каждого состояния газа будет характерна своя однозначная, вполне определенная величина внутренней энергии U. То есть U является функцией состояния газа. И разность внутренних энергий для двух каких-либо состояний рабочего тела или системы тел не будет зависеть от пути перехода от первого состояния во второе.
6. Первый закон термодинамики
Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов. Этот закон является законом сохранения и превращения энергии:
"Энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических процессах".
Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии т/д. системы:
" Теплота, подведенная к системе, расходуется на изменение энергии системы и совершение работы"
Уравнение первого закона термодинамики имеет следующий вид:
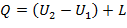 | (1.3.8) |
где Q - количества теплоты подведенная (отведенная) к системе; L - работа, совершенная системой (над системой); (U2 – U1) - изменение внутренней энергии в данном процессе.
Если:
Q > 0 – теплота подводится к системе;
Q < 0 – теплота отводится от системы;
L > 0 –работа совершается системой;
L < 0 – работа совершается над системой.
Для единицы массы вещества уравнение первого закона термодинамики имеет вид:
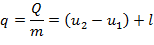 | (1.3.9) |
В дальнейшем все формулы и уравнения будут даны в основном для единицы массы вещества.
1-й закон т/д. указывает, что для получения полезной работы (L) в непрерывно действующем тепловом двигателе надо подводить (затрачивать) теплоту (Q).
"Двигатель, постоянно производящий работу и не потребляющий никакой энергии называется вечным двигателем I рода"
Из этого можно высказать следующее определение 1-го закона термодинамики:
" Вечный двигатель первого рода невозможен".
7. Теплоемкость газа
Истинная теплоемкость рабочего тела определяется отношением количества подведенной (отведенной) к рабочему телу теплоты в данном т/д. процессе к вызванному этим изменениям температуры тела.
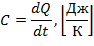 | (1.3.10) |
Теплоемкость зависит от внешних условий или характера процесса, при котором происходит подвод или отвод теплоты.
Различают следующие удельные теплоемкости:
массовую c 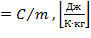 |
молярную 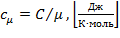 |
где μ - количества вещества [моль]:
объемную 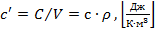
где - ρ = m / V - плотность вещества.
Связь между этими теплоемкостями:
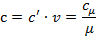
где - υ = V/m - удельный объем вещества, [м3/кг]; μ = m /ν – молярная (молекулярная) масса, [кг/моль].
Теплоемкость газов в большой степени зависит от тех условий, при которых происходит процесс их нагревания или охлаждения. Различают теплоемкости при постоянном давлении (изобарный) и при постоянном объеме (изохорный).
Таким образом различают следующие удельные теплоемкости:
ср, сv – массовые изобарные и изохорные теплоемкости;
сpμ, сvμ – молярные изобарные и изохорные теплоемкости;
с/p, с/v – объемные изобарные и изохорные теплоемкости.
Между изобарными и изохорными теплоемкостями существует следующая зависимость:
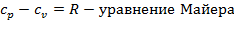 | (1.3.11) |
Теплоемкость зависит от температуры, которые даются в справочных литературах в виде таблицы как средние теплоемкости в интервале температур от 0 до tх. Для определения средней теплоемкости в интервале температур от t1 до t2 можно использовать следующую формулу:
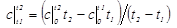 | (1.3.12) |
8. Смесь идеальных газов
Газовой смесью называется смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Газовая смесь подчиняется закону Дальтона:
«Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.»
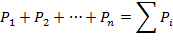 | (1.3.12) |
где Р1, Р2, Р3... Рn – парциальные давления.
Состав смеси задается объемными, массовыми и мольными долями, которые определяются соответственно по следующим формулам:
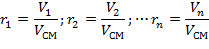 | (1.3.13) |
где V1; V2; … Vn; Vсм –объемы компонентов и смеси;
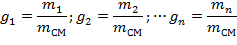 | (1.3.14) |
где m1; m2; … mn; mсм – массы компонентов и смеси;
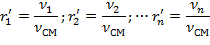 | (1.3.15) |
где ν1; ν2; … νn; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона:
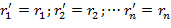 | (1.3.16) |
Так как
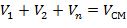
и
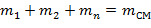
то
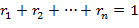 | (1.3.17) |
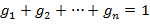 | (1.3.18) |
Связь между объемными и массовыми долями следующее:
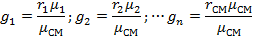 | (1.3.19) |
где: μ1, μ2, … μn, μсм – молекулярные массы компонентов и смеси.
Молекулярная масса смеси:
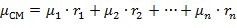 | (1.3.20) |
Газовая постоянная смеси:
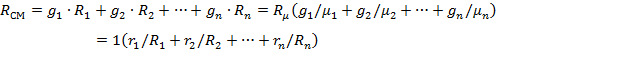 | (1.3.21) |
Удельные массовые теплоемкости смеси:
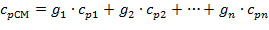 | (1.3.20) |
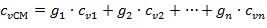 | (1.3.21) |
9. Универсальное уравнение состояния идеального газа
Идеальным газом называется такой газ, у которого отсутствуют силы взаимного притяжения и отталкивания между молекулами и пренебрегают размерами молекул. Все реальные газы при высоких температурах и малых давлениях можно практически считать как идеальные газы.
Уравнение состояния как для идеальных, как и для реальных газов описываются тремя параметрами по уравнению (1.3.7).
Уравнение состояния идеального газа можно вывести из молекулярно-кинетической теории или из совместного рассмотрения законов Бойля-Мариотта и Гей-Люссака.
Это уравнение было выведено в 1834 г. французским физиком Клапейроном и для 1 кг массы газа имеет вид:
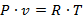 | (1.3.22) |
где: R - газовая постоянная и представляет работу 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1 градус.
Уравнение (1.3.22) называют термическим уравнением состояния или характеристическим уравнением.
Для произвольного количества газа массой m уравнение состояния будет:
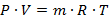 | (1.3.23) |
В 1874 г. Д.И.Менделеев, основываясь на законе Дальтона ("В равных объемах разных идеальных газов, находящихся при одинаковых температурах и давлениях, содержится одинаковое количество молекул") предложил универсальное уравнение состояния для 1 кг газа, которое называют уравнением Клапейрона-Менделеева:
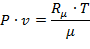 | (1.3.24) |
где: μ - молярная (молекулярная) масса газа, (кг/кмоль);
Rμ = 8314,20 Дж/кмоль (8,3142 кДж/кмоль) - универсальная газовая постоянная и представляет работу 1 кмоль идеального газа в процессе при постоянном давлении и при изменении температуры на 1 градус.
Зная Rμ можно найти газовую постоянную R = Rμ/μ.
Для произвольной массы газа уравнение Клапейрона-Менделеева будет иметь вид:
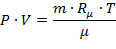 | (1.3.25) |
10. Энтропия
Одним из функций состояния термодинамической системы является энтропия. Энтропией называется величина, определяемая выражением:
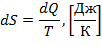 | (1.3.26) |
или для удельной энтропии:
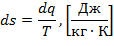 | (1.3.27) |
Энтропия есть однозначная функция состояния тела, принимающая для каждого состояния вполне определенное значение. Она является экстенсивным (зависит от массы вещества) параметром состояния и в любом термодинамическом процессе полностью определяется начальным и конечным состоянием тела и не зависит от пути протекания процесса.
Энтропию можно определить как функцию основных параметров состояния:
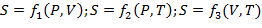 | (1.3.28) |
или для удельной энтропии:
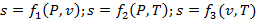 | (1.3.29) |
Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только его изменение в данном процессе, которые можно найти по следующим уравнениям:
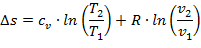 | (1.3.30) |
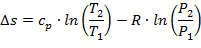 | (1.3.31) |
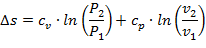 | (1.3.32) |
Если энтропия системы возрастает (Δs > 0), то системе подводится тепло.
Если энтропия системы уменьшается (Δs < 0), то системе отводится тепло.
Если энтропия системы не изменяется (Δs = 0, s = Const), то системе не подводится и не отводится тепло (адиабатный процесс).
11. Метод исследования термодинамических процессов
Как сказано выше первый закон т/д. устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом, количество теплоты подводимое к телу или отводимое от тела зависит от характера процесса.
К основным т/д. процессам относятся: изохорный, изотермический, изобарный и адиабатный.
Для всех этих процессов устанавливается общий метод исследования, который заключается в следующем:
- выводится уравнение процесса кривой Pυ и TS – диаграммах;
- устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
- определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
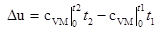 | (1.3.33) |
или при постоянной теплоемкости
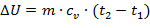 | (1.3.34) |
- вычисляется работа:
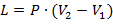 | (1.3.35) |
- определяется количество теплоты, участвующее в процессе:
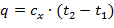 | (1.3.36) |
Все процессы рассматриваются как обратимые.
12. Изопроцессы идеального газа
1). Изохорный процесс (рис.1.3.1).
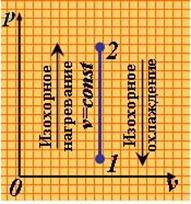 |
| Рис. 1.3.1. Изохорный процесс |
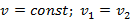
Уравнение состояния процесса:
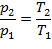 | (1.3.37) |
Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона т/д. имеет вид:
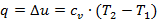 | (1.3.38) |
2). Изобарный процесс (рис.1.3.2).
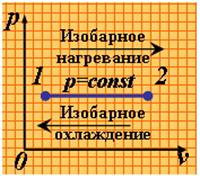 |
| Рис. 1.3.2. Изобарный процесс |
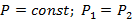
Уравнение состояния процесса:
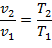 | (1.3.39) |
Работа этого процесса:
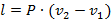 | (1.3.40) |
Уравнение 1-го закона т/д имеет вид:
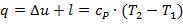 | (1.3.41) |
3). Изотермический процесс (рис.1.3.3).
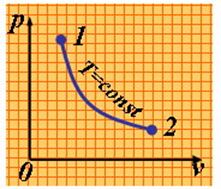 |
| Рис. 1.3.3. Изотермический процесс |
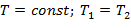
Уравнение состояния:
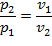 | (1.3.42) |
Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д. будет иметь вид:
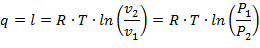 | (1.3.43) |
где R = Rh/ h – газовая постоянная [Дж/(кг·К)].
4). Адиабатный процесс (рис.1.3.4).
 |
| Рис. 1.3.4. Адиабатный процесс |
В данном процессе не подводится и не отводится тепло, т.е. q =0.
Уравнение состояния:
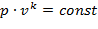 | (1.3.44) |
где k = cp / cv – показатель адиабаты.
Уравнение 1-го закона т/д будет иметь вид:
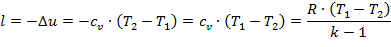 | (1.3.45) |
13. Политропный процесс
Политропным процессом называется процесс, все состояния которого удовлетворяются условию:
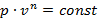 | (1.3.46) |
где n – показатель политропы, постоянная величина для данного процесса.
Изобарный, изохорный, изотермический и адиабатный процессы являются частными случаями политропного процесса (рис.1.3.5):
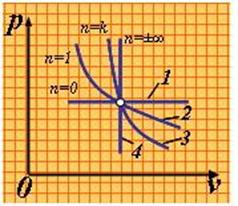 |
| Рис. 1.3.5. Политропный процессы: 1 – изобары; 2 – изотерма; 3 – адиабата; 4 - изохора |
при n = ± ¥ n = const, (изохорный),
n = 0 P = const, (изобарный),
n = 1 T = const, (изотермический),
n = k P· n = const, (адиабатный).
Работа политропного процесса определяется аналогично как при адиабатном процессе:
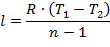 | (1.3.47) |
Теплота процесса:
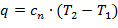 | (1.3.48) |
где cn – массовая теплоемкость политропного процесса.
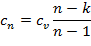
14. Основные положения второго закона термодинамики
Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения.
Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сама собой может переходить от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию.
Таким образом, для полного анализа явления и процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу.
Формулировки второго закона термодинамики.
Для существования теплового двигателя необходимы 2 источника – горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника, то он называется вечным двигателем 2-го рода.
1 формулировка (Оствальда):
"Вечный двигатель 2-го рода невозможен".
Вечный двигатель 1-го рода это тепловой двигатель, у которого L>Q1, где Q1 - подведенная теплота. Первый закон термодинамики "позволяет" возможность создать тепловой двигатель, полностью превращающий подведенную теплоту Q1в работу L, т.е. L = Q1. Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты (L<Q1) на величину отведенной теплоты – Q2, т.е. L = Q1 - Q2.
Вечный двигатель 2-го рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует 2-я формулировка (Клаузиуса):
"Теплота не может самопроизвольно переходит от более холодного тела к более нагретому".
Для работы теплового двигателя необходимы 2 источника – горячий и холодный. 3-я формулировка (Карно):
"Там где есть разница температур, возможно совершение работы".
Все эти формулировки взаимосвязаны, из одной формулировки можно получить другую.
15. Циклы. Прямой и обратный циклы Карно
Пусть рабочее тело (газ) из начального состояния (точка 1, рис. 1.3.6) под воздействием внешних сил переходит через точку В в конечное состояние (точка 2).
 |
| Рис. 1.3.6. Круговой процесс (цикл) |
В этом случае полученная работа будет равна площади ограниченной замкнутой линией 1В22′1′1, Если рабочее тело из состояния ввернется в исходное состояние 1, то говорят, что осуществлен круговой процесс (или цикл).
Если рабочее тело из состояния 2 возвращается в состояние по пути через точку В, то работа цикла равна нулю. Для того чтобы рабочее тело совершало полезную работу, необходимо, чтобы рабочее тело возвращалось по пути 2А1, т, е. линия расширения должна быть выше линии сжатия.
Полезная работа расширения определяется по следующей формуле:
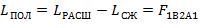 | (1.3.49) |
Циклы бывают прямые и обратные.
Прямым называется цикл, в котором теплота преобразуется в работу. В этом цикле линия расширения на pv-диаграмме расположена выше линии процесса сжатия, т. е. система совершает положительную работу (LПОЛ > 0). Цикл изображается в виде замкнутой кривой, проходимой рабочим телом по часовой стрелке. По прямым циклам работают все тепловые двигатели.
В обратном цикле теплота передается от менее нагретого тела к более нагретому. В системе координат рv линия процесса сжатия расположена выше линии процесса расширения (АПОЛ <0). Работа цикла осуществляется от постороннего источника. Цикл изображается в виде замкнутой кривой, проходимой рабочим телом против часовой стрелки. Такой цикл осуществляет холодильная установка.
Для прямого цикла согласно первому закону термодинамики
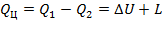 | (1.3.50) |
где QЦ — теплота, полезно использованная в цикле; Q1 — подведенная теплота к рабочему телу от горячего источника; Q2 — теплота, отведенная от рабочего тела; L — работа, произведенная двигателем за цикл; ΔU— изменение внутренней энергии.
Однако в круговом цикле ΔU= 0, так как рабочее тело возвращается в первоначальное состояние, Поэтому
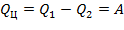 | (1.3.51) |
Отношение теплоты QЦ, превращенной в работу, к теплоте Q1, затраченной для совершения кругового цикла, называется термическим КПД:
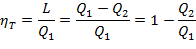 | (1.3.52) |
Термический КПД hT показывает, какая доля теплоты Q1 превращается в работу и изменяется в пределах
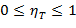 | (1.3.53) |
Эксергией (работоспособностью) теплоты Q1 отбираемой от горячего источника с температурой T1 называется максимальная полезная работа, которая может быть получена за счет этой теплоты при условии, что холодным источником является окружающая среда с температурой Т0.
Цикл Карно — самый совершенный из всех идеальных циклов, так как имеет максимальный термический КПД.
Прямой цикл Карно. Пусть рабочее тело (идеальный газ) помещено в цилиндр, стенки и поршень которого абсолютно теплоизолированы. Дно цилиндра попеременно сообщается с источником высокой температуры Т1 и низкой — Т2 причем Т1 > Т2. Рассмотрим все четыре процесса цикла (рис. `1.3.7).
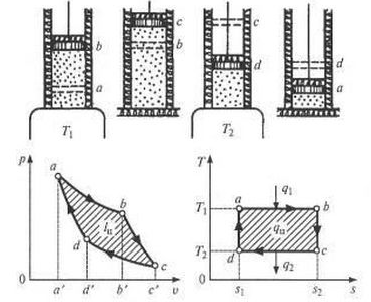 |
| Рис. 1.3.7. Прямой цикл Карно |
Процесс (а—b) — изотермическое расширение. Дно цилиндра находится в термическом контакте с источником теплоты. Система получает теплоту q1, соприкасаясь с горячим источником T1, и изотермически расширяется по линии а—b, совершая работу, Точка а соответствует начальному состоянию газа (поршень находится в НМТ — нижней мертвой точке) в p,v- и Т,s-диаграммах. Площадь a—b—s2—s1 в Т,s-диаграмме равна количеству теплоты, подведенной к рабочему телу:
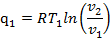 | (1.3.54) |
В точке b источник q1 убирается от цилиндра, и система термически изолируется (дно цилиндра покрывается идеальным теплоизолирующим материалом).
Второй процесс (b—с) — адиабатное расширение. Газ расширяется без теплообмена с внешней средой, поршень перемещается, и газ совершает работу за счет своей внутренней энергии. При этом температура и давление падают. Движение поршня прекращается в точке с, когда температура газа достигнет температуры холодильника Т2. После этого цилиндр приводится в контакт с холодильником и начинается следующий процесс. Удельная работа равна
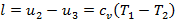 | (1.3.55) |
Третий процесс (с—d) — изотермическое сжатие. Карно предложил осуществлять процесс сжатия по изотерме c—d, при этом поршень возвращается настолько медленно, что газ остается при температуре холодильника T2, объем его уменьшается, а давление растет. На участке c—d теплота q2, равная площади c—d—sl—s2, отводится:
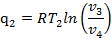 | (1.3.56) |
Четвертый процесс (d—a) — адиабатное сжатие. Сжатие газа внешними силами осуществляется без теплообмена. Его объем уменьшается, температура и давление растут. Когда температура достигает температуры источника теплоты, процесс сжатия прекращается, и цикл Карно замыкается.
В цикле Карно на pv-диаграмме работа равна площади ограниченной линии a—b—c—d—а. На Ts-диаграмме площадь a—b—c—d—a численно равна теплоте цикла, преобразованной в полезную работу.
Термический КПД цикла Карно определяется по следующей формуле:
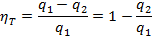 | (1.3.57) |
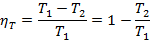 | (1.3.58) |
Анализ уравнения (1.3.58) показывает, что для цикла Карно характерно:
- значение термического КПД не зависит от свойств рабочего тела, а определяется только значениями абсолютных температур;
- значение термического КПД возрастает с увеличением значения Т1 и уменьшается с уменьшением значения Т2.
- значение термического КПД всегда меньше 1. Если Т1 = Т2 то КПД = 0, т. е. теплота не превращается в работу;
- термический КПД при изотермических источниках имеет максимальное значение в заданном диапазоне температур по сравнению с другими циклами и, следовательно, является эталоном, с которым сравнивают циклы существующих тепловых машин.
Обратный цикл Карно. Если провести цикл Карно в обратном направлении (против часовой стрелки), то получим обратный цикл (рис. 1.3.8).
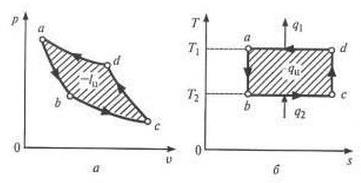 |
| Рис. 1.3.8. Обратный цикл Карно |
Из точки а с параметрами pа, vа и Та рабочее тело адиабатно расширяется до точки b и соединяется с источником низкой температуры Т2. Дальнейший процесс b—с происходит с подводом теплоты Q2 к рабочему телу (изотермическое расширение), В точке с рабочее тело вновь изолируется от источника теплоты и в процессе c—d сжимается адиабатно с повышением температуры от Т2 до Т1. В точке d рабочее тело соединяется с источником высокой температуры, и дальнейшее его сжатие происходит по изотерме d—а с отводом теплоты Q1 высокотемпературному источнику. В точке а рабочее тело возвращается в первоначальное состояние. Таким образом, обратный цикл Карно состоит из двух изотерм и двух адиабат, В результате такого цикла теплота от источника с более низкой температурой передается к источнику с более высокой температурой, при этом внешними силами затрачивается работа.
Холодильный коэффициент εX определяется по следующей формуле:
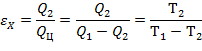 | (1.3.59) |
Из анализа выражения (1.3.59) следует:
- значение холодильного коэффициента зависит только от значения температуры горячего и холодного источников и не зависит от природы рабочего тела;
- значение холодильного коэффициента тем больше, чем меньше значение разности температур горячего и холодного источников;
- холодильный коэффициент может изменяться от нуля до бесконечности;
- холодильный коэффициент для цикла Карно имеет максимальное значение и является эталоном, с которым сравнивают циклы существующих холодильных машин.
16. Первый закон термодинамики для потока
На практике при рассмотрении рабочих процессов машин, аппаратов и устройств, встречаются задачи изучении закономерностей движения рабочих тел (газов, пара и жидкостей).
Уравнение 1-го закона термодинамики для потока газа при следующих допущениях:
- движение газа по каналу установившееся и неразрывное;
- скорости по сечению, перпендикулярному оси канала, постоянны;
- пренебрегается трение частичек газа друг другу и о стенки канала;
- изменение параметров по сечению канала мало по сравнению их абсолютными значениями,
имеет вид:
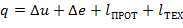 | (1.3.60) |
где De – изменение энергии системы, состоящей из изменения кинетической и потенциальной энергий; lПРОТ. – работа проталкивания, затрачиваемая на движения потока; lТЕХН. – техническая (полезная) работа (турбины, компрессора, насоса, вентилятора и т.д.).
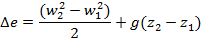
где w1,w2 – скорости потока в начале и в конце канала; z1, z2 – высота положения начала и конца канала.
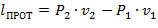
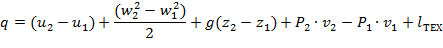 | (1.3.61) |
Введем понятия энтальпии, которым обозначим через величину:
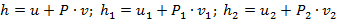 | (1.3.62) |
Тогда уравнение 1-го закона термодинамики для потока газа будет иметь вид:
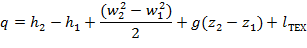 | (1.3.63) |
17. Критическое давление и скорость. Сопло Лаваля
Если перемещение газа по каналу происходит его расширение с уменьшением давления и увеличением скорости, то такой канал называется соплом.
Если в канале происходит сжатие рабочего тела с увеличением его давления и уменьшением скорости, то такой канал называют диффузором.
В каналах при небольшой разности давлений газа и внешней среды скорость течения рабочего тела достаточно большая. В большинстве случаев длина канала небольшая и процесс теплообмена между стенкой и газом незначителен, поэтому процесс истечения газа можно считать адиабатным.
Скорость истечения (на выходе канала) определяется из уравнения:
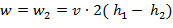 | (1.3.64) |
или
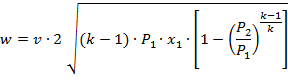 | (1.3.65) |
Массовый секундный расход газа, [кг/с]:
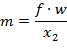 | (1.3.66) |
где: f – площадь сечения канала на выходе.
Так как процесс истечения адиабатный, то:
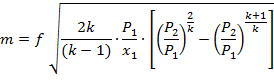 | (1.3.67) |
Массовый секундный расход идеального газа зависит от площади выходного канала, начального состояния газа и степени его расширения.
Критическим давлениемназывается такое давление на выходном сечении канала, при котором достигается максимальный расход газа и определяется следующим выражением:
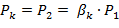 | (1.3.68) |
для одноатомных газов: k =1,66, bК = 0,49;
для двухатомных газов: k =1,4, bК = 0,528;
для трехатомных газов: k =1,3, bК = 0,546.
Критической скоростью называется скорость газа в выходном сечении канала, при давлении равном или меньшем критического - PК.
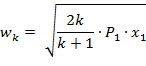 | (1.3.69) |
Критическая скорость зависит при истечении идеального газа только от начальных параметров, его природы и равна скорости звука газа (а) при критических параметрах.
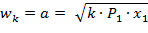 | (1.3.70) |
Комбинированное сопло Лаваля предназначено для использования больших перепадов давления и для получения скоростей истечения, превышающих критическую или скорость звука. Сопло Лаваля состоит из короткого суживающегося участка и расширяющейся конической насадки (рис. 1.3.9).
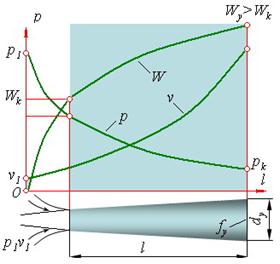 |
| Рис. 1.3.9. График изменения p, W, v при истечении через комбинированное сопло |
Опыты показывают, что угол конусности расширяющейся части должен быть равен a = 8-12о. При больших углах наблюдается отрыв струи от стенок канала.
Скорость истечения и секундный расход идеального газа определяются по формулам (1.3.64) и (1.3.66).
Длину расширяющейся части сопла можно определить по уравнению:
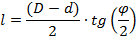 | (1.3.71) |
где: j - угол конусности сопла; D - диаметр выходного отверстия; d - диаметр сопла в минимальном сечении.
18. Дросселирование
Дросселированием называется явление, при котором пар или газ переходит с высокого давления на низкое без совершения внешней работы и без подвода или отвода теплоты. Такое явление происходит в трубопроводе, где имеется место сужения проходного канала (рис. 1.3.10).
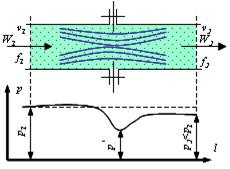 |
| Рис. 1.3.10. Дросселирование газов |
При таком сужении, вследствие сопротивлений, давление за местом сужения - Р2, всегда меньше давления перед ним – Р1.
Любой кран, вентиль, задвижка, клапан и прочие местные сопротивления, уменьшающие проходное сечение трубопровода, вызывают дросселирования газа или пара, следовательно, падения давления. В большинстве случаев это явление приносит безусловный вред. Но иногда оно бывает необходимым и создается искусственно (регулирование паровых двигателей, в холодильных установках, в приборах для измерения расхода газа и т.д.).
При прохождении газа через отверстие, кинетическая энергия газа и его скорость в узком сечении возрастают, что сопровождается падением температуры и давления.
Газ, протекая через отверстие, приходит в вихревое движение. Часть его кинетической энергии затрачивается на образование этих вихрей и превращается в теплоту. Кроме того, в теплоту превращается и работа, затраченная на преодоление сопротивлений (трение). Вся эта теплота воспринимается газом, в результате чего температура его изменяется (уменьшается или увеличивается).
В отверстие скорость газа увеличивается. За отверстием газ опять течет по полному сечению и скорость его вновь понижается. А давление увеличивается, но до начального значения оно не поднимается; некоторое изменение скорости произойдет в связи с увеличением удельного объема газа от уменьшения давления.
Дросселирование является необратимым процессом, при котором происходит увеличение энтропии и уменьшение работоспособности рабочего тела.
Уравнением процесса дросселирования является следующее уравнение:
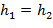 | (1.3.72) |
Это равенство показывает, что энтальпия в результате дросселирования не изменяется и справедливо только для сечений, достаточно удаленных от сужения.
Для идеальных газов энтальпия газа является однозначной функцией температуры. Отсюда следует, что при дросселировании идеального газа его температура не изменяется (Т1 = Т2).
При дросселировании реальных газов энтальпия газа остается постоянной, энтропия и объем увеличиваются, давление падает, а температура изменяется (увеличивается, уменьшается или остается неизменной).
Изменение температуры жидкостей и реальных газов при дросселировании называется эффектом Джоуля-Томсона. Для идеального газа эффект Джоуля-Томсона равен нулю. Различают дифференциальный температурный эффект, когда давление и температура изменяются на бесконечно малую величину, и интегральный температурный эффект, при котором давление и температура изменяются на конечную величину.
Состояние газа, при котором температурный эффект меняет свой знак, называется точкой инверсии, а температура, соответствующая этой точке, называется температурой инверсии - Тинв.
19. Свойства реальных газов
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют объемы и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между молекулами. При практических расчетах различных свойств реальных газов наряду с уравнением состояния применяется отношение P·n/(R·T)= c, которая называется коэффициентом сжимаемости.
Так как для идеальных газов при любых условиях P·n = R·T, то для этих газов с = 1. Тогда величина коэффициента сжимаемости выражает отклонение свойств реального газа от свойств идеального. Величина с для реальных газов в зависимости от давления и температуры может принимать значения больше или меньше единицы и только при малых давлениях и высоких температурах она практически равна единице. Тогда реальные газы можно рассматривать как идеальные.
В связи с отличием свойств реального газа от свойств идеального газа нужно иметь новые уравнения состояния, которые связывали бы значения P, х, T и давали бы возможность рассчитывать некоторые свойства газов для разных условий. Были предложены многочисленное число различных уравнений состояния реальных газов, но ни одно из них не решает проблему для общего случая. Развитие кинетической теории газов, позволило установить точное уравнение состояния реальных газов в виде:
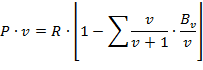 | (1.3.73) |
где Bn – вириальные коэффициенты, выражаются через потенциальные энергию взаимодействия молекул данного газа и температуру Т.
Однако это уравнение в общем виде не может быть использовано для непосредственных расчетов реальных газов. Для отдельных частных случаев получены расчетные уравнения того или иного реального газа. Из-за сложности вычисления вириальных коэффициентов обычно ограничиваются расчетом первых двух коэффициентов. Тогда расчетное уравнение имеет вид:
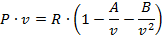 | (1.3.74) |
где А и В - первый и второй вириальные коэффициенты, являющиеся функцией только температуры.
При расчете свойств многих реальных газов уравнения такого типа получили большое распространение.
20. Уравнения состояния реального газа
Наиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса:
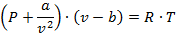 | (1.3.74) |
где а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул.
a/n2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 МПа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/n2 внешнее давление легко изменяет их объем.
Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо.
На Pv – диаграмме (рис. 1.3.11) показаны изотермы, построенные по уравнению Ван-дер-Ваальса.
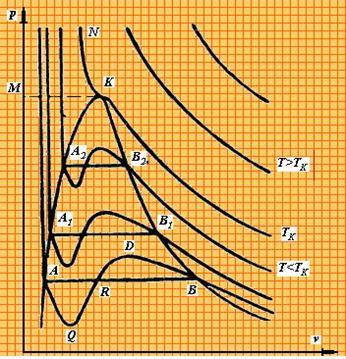 |
| Рис. 1.3.11. P-v диаграмма реальных газов |
Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре. Точка А соответствует состоянии жидкости, точка В относится парообразному состоянии вещества.
В действительности переход из жидкого состояния в парообразное всегда происходит через двухфазное состояние вещества. При этом при данной температуре процесс перехода происходит также и при постоянном давлении. Этот действительный переход из жидкого состояния в парообразное изображается прямой линией АВ.
Практически для особо чистых веществ возможно осуществление участков волнообразной кривой AQ и DB. В первом случае имеют место неустойчивые состояния перегретой жидкости, а во втором – переохлажденного пара.
При определенной температуре изотерма уравнения Ван-дер-Ваальса не будет иметь волнообразного участка (точка К). Эту температуру называют критической. Если соединить точки А1, А2, А3 … и В1, В2, В3... получим кривую похожую на параболу. Кривая АК называется нижней пограничной кривой и соответствует в состоянии кипения жидкости. Кривая КВ называется верхней пограничной кривой и соответствует состояния сухого насыщенного пара.
Таким образом, для реального вещества PV – диаграмму можно разбить на 3 области:
1 - область жидкого состояния, расположена левее нижней пограничной кривой;
2 - область двухфазных состояний (влажный пар), расположена между нижней и верхней пограничной кривой);
3 – область перегретого пара, расположена правее верхней пограничной кривой и выше критической точки. Условно область жидкости ограничивают сверху линией КМ – критическая изобара.
Критическую температуру Д.И.Менделеев называл абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю, т.е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром).
21. Понятия о водяном паре
Самым распространенным рабочим телом в паровых турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменниках является водяной пар.
Пар - газообразное тело в состоянии, близкое к кипящей жидкости.
Парообразование – процесс превращения вещества из жидкого состояния в парообразное.
Испарение – парообразование, происходящее всегда при любой температуре с поверхности жидкости.
При некоторой определенной температуре, зависящей от природы жидкости и давления, под которым она находится, начинается парообразование во всей массе жидкости. Этот процесс называется кипением.
Обратный процесс парообразования называется конденсацией. Она также протекает при постоянной температуре.
Процесс перехода твердого вещества непосредственно в пар называется сублимацией. Обратный процесс перехода пара в твердое состояние называется десублимацией.
При испарении жидкости в ограниченном пространстве (в паровых котлах) одновременно происходит обратное явление – конденсация пара. Если скорость конденсации станет равной скорости испарения, то наступает динамическое равновесие. Пар в этом случае имеет максимальную плотность и называется насыщенным паром.
Если температура пара выше температуры насыщенного пара того же давления, то такой пар называется перегретым. Разность между температурой перегретого пара и температурой насыщенного пара того же давления называется степенью перегрева. Так как удельный объем перегретого пара больше удельного объема насыщенного пара, то плотность перегретого пара меньше плотности насыщенного пара. Поэтому перегретый пар является ненасыщенным паром.
В момент испарения последней капли жидкости в ограниченном пространстве без изменения температуры и давления образуется сухой насыщенный пар. Состояние такого пара определяется одним параметром - давлением.
Механическая смесь сухого и мельчайших капелек жидкости называется влажным паром
Массовая доля сухого пара во влажном паре называется степенью сухости – х.
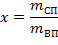 | (1.3.75) |
где mСП - масса сухого пара во влажном; mВП - масса влажного пара.
Массовая доля жидкости во влажном паре называется степенью влажности – у.
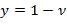 | (1.3.76) |
Для кипящей жидкости при температуре насыщения n = 0, для сухого пара – n = 1.
22. Характеристики влажного воздуха
Атмосферный воздух, в основном состоящий из кислорода, азота, углекислого газа, содержит всегда некоторое количество водяного пара.
Смесь сухого воздуха и водяного пара называется влажным воздухом.
Влажный воздух при данном давлении и температуре может содержать разное количество водяного пара. Если смесь состоит из сухого воздуха и насыщенного водяного пара, то его называют насыщенным влажным воздухом. В этом случае во влажном воздухе находится максимально возможное для данной температуры количество водяного пара. При охлаждении этого воздуха, будет происходить конденсация водяного пара. Парциальное давление водяного пара в этой смеси равно давлению насыщения при данной температуре.
Если влажный воздух содержит при данной температуре водяной пар в перегретом состоянии, то он будет называться ненасыщенным. Так как в нем находится не максимально возможное для данной температуры количество водяного пара, то он способен к дальнейшему увлажнению. Поэтому такой воздух используют в качестве сушильного агента в различных сушильных установках.
По закону Дальтона общее давление влажного воздуха равно сумме парциальных давлений сухого воздуха и водяного пара, входящих в его состав:
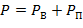 | (1.3.77) |
где: РВ – парциальное давление сухого воздуха; РП - парциальное давление водяного пара.
Максимальное значение РП при данной температуре влажного воздуха t представляет собой давление насыщенного водяного пара - РН.
Для нахождения парциального давления пара пользуются специальным прибором – гигрометром. С помощью этого прибора определяют точку росы, т.е. температуру (tp), до которой нужно охладить при постоянном давлении воздух, чтобы он стал насыщенным. Зная точку росы, можно по таблицам определить парциальное давление пара в воздухе как давление насыщения (РН), соответствующее точки росы tp.
Абсолютной влажностью воздуха называется количество водяных паров, находящихся в 1 м3 влажного воздуха. Абсолютная влажность равна плотности пара при его парциальном давлении и температуре воздуха – tн .
Отношение абсолютной влажности ненасыщенного воздуха при данной температуре к абсолютной влажности насыщенного воздуха при той же температуре называется относительной влажностью воздуха
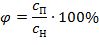 | (1.3.78) |
Для сухого воздуха j = 0, для ненасыщенного j < 1, для насыщенного j = 1(100%).
Если водяной пар считать как идеальный газ, то по закону Бойля-Мариотта отношение плотностей можно заменить отношением давлений.
Плотность влажного воздуха слагается из масс, содержащихся в 1 м3 сухого воздуха и водяных паров:
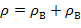 | (1.3.79) |
Влагосодержание – представляет собой отношение массы пара к массе сухого воздуха:
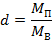 | (1.3.80) |
где: МП, МВ
 2015-02-04
2015-02-04 3050
3050