Номенклатура. В ряду карбоновых кислот чаще всего используют тривиальные названия, многие из которых указывают на источник получения карбоновых кислот.
По систематической номенклатуре название карбоновых кислот образуется от названия соответствующих алканов с добавлением окончания «овая» и слова «кислота». Нумерацию углеводородной цепочки начинают с углерода карбоксильной группы.

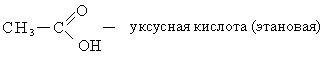
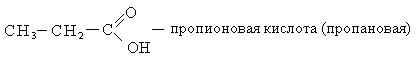
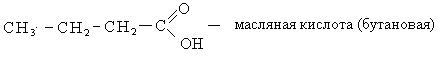
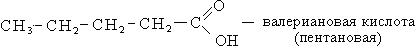
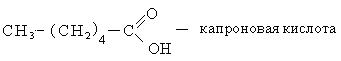
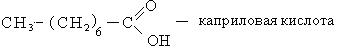
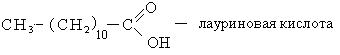
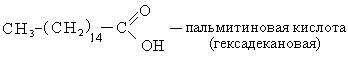
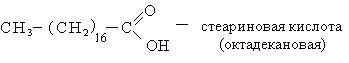
Способы получения. Известен ряд общих способов получения кислот.
1. Каталитическое окисление парафиновых углеводородов кислородом воздуха:
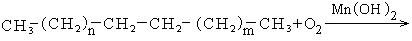
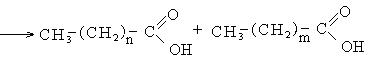
В промышленности для получения карбоновых кислот используют парафиновые углеводороды с числом углеродных атомов С20 – С40 и получают кислоты С10 – С20.
2. Реакция оксосинтеза:
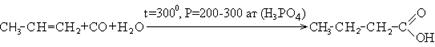
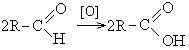
Необходимые для синтеза кислот, альдегиды получают по реакции Кучерова или каталитическим дегидрированием спиртов.
4. Гидролиз нитрилов:
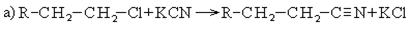
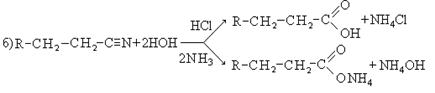
5. Гидролиз геминальных галогенпроизводных:
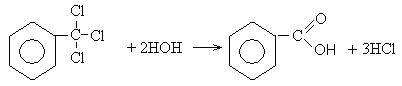
6. Гидролиз жиров:
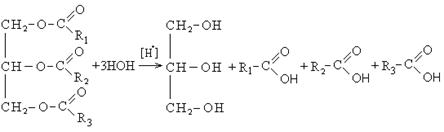
Химические свойства карбоновых кислот. Химические свойства карбоновых кислот определяются теми электронными эффектами, которые действуют в карбоксильной группе и молекуле в целом.
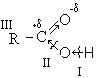
Электронная структура молекулы позволяет выделить следующие основные направления протекания химических реакций карбоновых кислот:
― реакции с разрывом связи О-Н (направление I);
― реакции с разрывом связи С-О (направление II);
― реакции в углеводородном радикале (направление III).
I. Кислотно-основные свойства кислот (направление I). Влияние кислорода карбонильной группы приводит к накапливанию частично положительного заряда на атоме углерода, что в свою очередь, за счет индукционного эффекта, приводит к значительному снижению электронной плотности на кислороде гидроксильной группы, вследствие чего протон практически не удерживается, легко отрывается и кислоты обладают ярко выраженными кислотными свойствами.
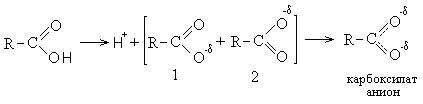
Диссоциация кислот с отрывом протона выгодна и энергетически, так как при этом образуется карбоксилат анион, стабилизированный резонансом и обладающий меньшей энергией, чем исходная кислота. Карбоксилат-анион является гибридом двух структур (1 и 2), стабилизированных резонансом. В карбоксилат-анионе атом находится в состоянии sp2- гибридизации. Не спаренный p- электрон углерода одинаково равномерно перекрывается с p- электроном двух атомов кислорода.
Присутствие галогена в алкильном радикале усиливает кислотные свойства кислот. Наиболее сильной кислотой является трихлоруксусная кислота. Легкость отрыва протона в трихлоруксусной кислоте объясняется отрицательным индукционным эффектом галогена, что уменьшает электронную плотность на карбоксилат-анионе и дестабилизирует его.
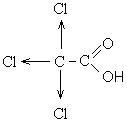
Кислотность галогензамещенных карбоновых кислот изменяется в следующем порядке:
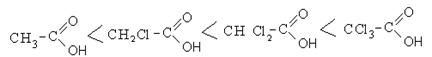
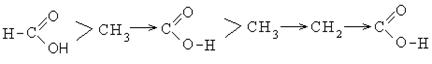
Присутствие донорных заместителей в алкильном радикале увеличивает электронную плотность на карбоксилат-анионе и протон сильнее удерживается им.
В этом ряду муравьиная кислота обладает большими кислыми свойствами, чем уксусная.
Карбоновые кислоты взаимодействуют с активными металлами, гидроксидами металлов, солями:
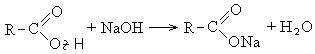
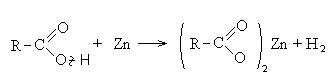
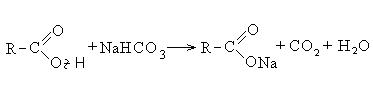
II Реакции с разрывом связи С-ОН (направление II).
Реакции с разрывом связи С-ОН протекают по механизму нуклеофильного замещения (SN) и приводят к образованию так называемых функциональных производных карбоновых кислот. К ним относятся:
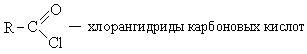
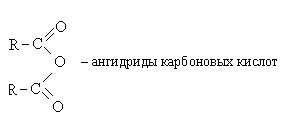
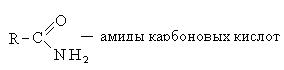
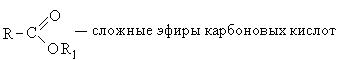
Механизм реакций нуклеофильного замещения сводится к следующему:
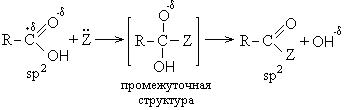
 - нуклеофил.
- нуклеофил.
1. Образование хлорангидридов карбоновых кислот:
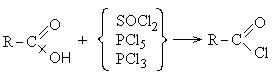
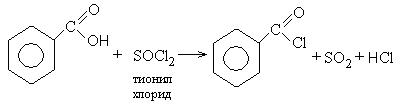
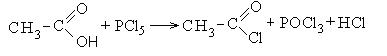
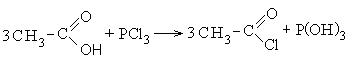
Хлорангидриды карбоновых кислот являются реакционно способным классом соединений и широко используются в органическом синтезе для получения диоксикетонов и карбоновых кислот:
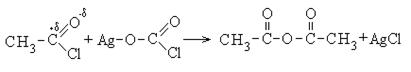
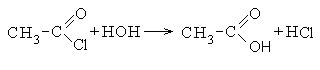
2. Образование ангидридов карбоновых кислот:
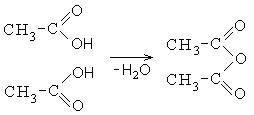
Ангидриды карбоновых кислот также являются реакционно-способными соединениями. Ангидрид уксусной кислоты используется как ацелирующий агент:
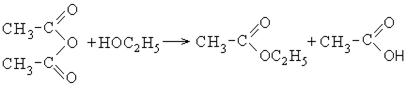
При растворении уксусного ангидрида в воде образуется уксусная кислота.
3. Образование амидов карбоновых кислот:
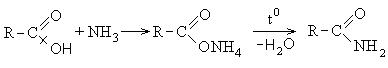
4. Образование сложных эфиров:
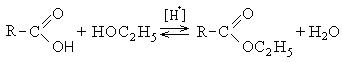
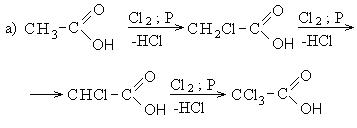
III. Реакции в углеводородном радикале (направление III). Эти реакции протекают по механизму радикального замещения (SR):
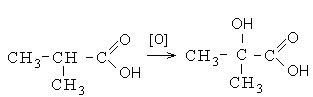
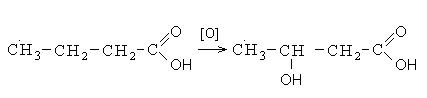
Кроме выше перечисленных направлений взаимодействия карбоновые кислоты вступают в реакции окисления. Окисление карбоновых кислот протекает в жестких условиях с образованием оксикислот. В неразветвленных карбоновых кислотах окисление проходит в β- положении, а в разветвленных – в α-положении к углероду карбонильной группы:
Применение карбоновых кислот. Муравьиная кислота – жидкость с резким запахом. В промышленности муравьиную кислоту получают из формиата натрия, который образуется при пропускании оксида углерода через раствор едкого натра.
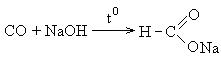
Полученную соль действием серной кислоты переводят в свободную кислоту:
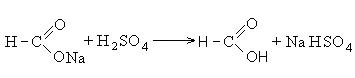
Муравьиная кислота широко распространена в природе. Она содержится в крапиве, хвое, является продуктом жизнедеятельности муравьев. Муравьиная кислота используется как консервирующий агент. Раствор её в этаноле известен как муравьиный спирт.
Уксусная кислота. Эту кислоту называют еще ледяной, так как при +16,5 0С она застывает в кристаллическую массу. Уксусная кислота обладает характерным острым запахом и смешивается с водой в любых соотношениях. 3-5% раствор уксусной кислоты известен под названием уксуса, а 70-80 % раствор как уксусная эссенция. Для пищевых целей уксусную кислоту получают уксусно-кислым брожением.
Высокомолекулярные карбоновые кислоты (пальмитиновая и стеариновая). Смесь этих кислот называют стеарином. Стеарин применяется для изготовления свеч, создания основы для губных помад, обувных кремов. Стеарин получают возгонкой гидролизованного жира. Высокомолекулярные карбоновые кислоты с числом углеродных атомов С10-С20 используется для получения активной основы синтетических моющих средств.
В качестве активной основы моющих средств обычно выступают алкилсульфаты. Общая схема получения алкилсульфанатов сводится к следующему:
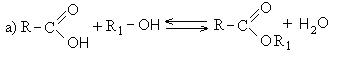

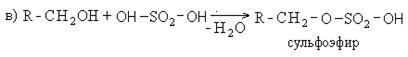
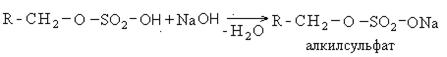
Содержание алкилсульфатов в рецептурах синтетических моющих средств составляет 30%. Они являются поверхностно активными веществами и обладают высокой моющей способностью.
Моющее действие поверхностно-активных веществ. Поверхностно-активными веществами называются соединения, способные адсорбироваться на поверхности раздела фаз и изменять их поверхностное натяжение. К поверхностно активным веществам, обладающим моющими свойствами, относятся:
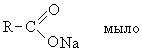
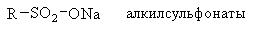
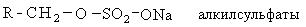
Структуру поверхностно-активных веществ можно рассматривать состоящей из двух фрагментов: гидрофильная часть, то есть растворимая в воде и гидрофобная часть, представленная длинноцепочным углеводородным радикалом, нерастворимая в воде.
Моющее действие поверхностно-активных веществ объясняется следующими факторами: при гидролизе поверхностно активных веществ создается щелочная среда, которая вызывает эмульгирование жиров с поверхности. Сами поверхностно-активные вещества обеспечивают стабильность этих эмульсий. Стойкие эмульсии образуются за счет адсорбции поверхностно-активных веществ на поверхности жировых капель, что не позволяет этим каплям (грязи) соединяться друг с другом и грязь не оседает на ткани, а остается в водной среде и удаляется.
 2015-03-20
2015-03-20 6027
6027
