Когда цепи ДНК разъединены, молекула ДНК становиться достаточно уязвимой и нестабильной.. Все возможные нарушения в структуре одиночных цепей исключаются благодаря действию белков SSВ (Single strand DNA-binding proteins или helix-destabilizing proteins). Они связываются с одиночными цепями, стабилизируют их, при этом не закрывая оснований и оставляя их доступными для ДНК-полимеразы. SSB белок сам не способен разделять нити ДНК, но помогает геликазе выравнивать их, подготавливая основу для синтеза. Двухдоменный белок покрывает 8 нуклеотидных пар, при этом не закрывая их. Так как один белок пристраивается сразу же за другим, то они способны быстро покрывать однонитевую ДНК, по мере ее появления и препятствовать образованию РНК-подобных шпилечных структур. Обычно работает в тетрамерной форме, сразу покрывая 32 нуклеотида. Как происходит присоединение SSB к ДНК
показано на рис…
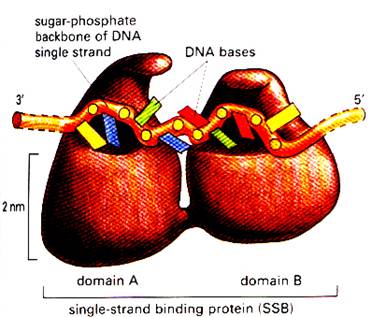
Рис… Строение белка SSB E.coli
Одним из ключевых факторов эукариотической репликации является гомолог SSB репликативный белок А. Этот белок состоит из полипептидов с молекулярной массой 70 (р70), 32 (р32) и 14 (р14) кДа,.т.е. является гетеротримером. RРА известен как фактор, связывающий однонитевую ДНК. Сродство RРА к двунитевой ДНК на 3 порядка ниже. На определенных этапах репликации, рекомбинации или репарации ДНК комплементарные цепи разделяются и последующие превращения происходят уже с однонитевой ДНК. RРА стабилизирует однонитевую ДНК, нарушая ее вторичную структуру.
Основные ДНК-связывающие домены RPA (А, В и С) входят в состав р70 субъединицы. При связывании однонитевой ДНК RРА претерпевает значительные конформационные перестройки, модулируемые длиной выступающего участка матричной цепи. Недавно была выяснена роль р32 субъединицы RPA в связывании RРА с ДНК. В случае ДНК-дуплексов с выступающим участком матрицы размером 30 и 18 н. наблюдали преимущественное ковалентное присоединение р32-субъединицы к 3'-концу праймера, в то время как укорочение матричной цепи до 13-12 н. и далее обеспечивало в основном ковалентное присоединение субъединицы р70. р32 субъединица RРА размещается вблизи З'-конца праймера при протяженном матричном участке и удаляется из области контакта с З'-концом праймера при укорочении матрицы. С помощью электронной микроскопии показано, что RРА в комплексе с однонитевой ДНК принимает в зависимости от длины участка ДНК элонгированную, сжатую или глобулярную конформации. Это показано на рис….
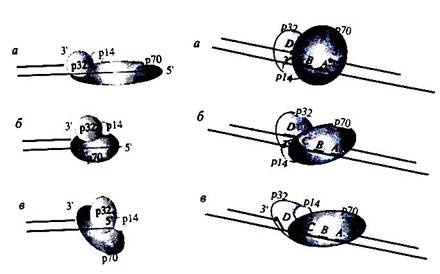
Рис… Конформационные изменения RPA
Предполагалось, что в этих конформациях изменяется расположение субъединиц RРА относительно З'-конца растущей цепи. В вытянутой конформации RРА субъединица р32 расположена вблизи З'-конца растущей цепи ДНК, в то время как изменение конформации RРА к сжатой и далее к глобулярной форме удаляет р32 от ее З'-конца. Изменение конформаиии RРА зависит исключительно от длины выступающего участка матрицы.
В районах однонитевых брешей однонитевая ДНК связывается с А и В ДНК-связывающими доменами субъединицы р70, при этом 5'-конец ДНК взаимодействует с доменом А, в то время как домен В расположен ближе к З'-концу, что говорит о преимущественном взаимодействии р70 с З'-концом бреши.
В соответствии с полученными результатами предложена модель, позволяющая рассмотреть возможное расположение RРА в брешах. В случае короткой бреши размером 9-10н, RРА связывается с однонитевым участком бреши, взаимодействуя с основными ДНК-связывающими доменами А и В субъединицы р70. При этом RРА находится в глобулярной конформации, в которой субъединица р32 практически не контактирует с З'-концом праймера. В протяженной бреши RРА принимает вытянутую конформацию, в которой контакты р32 с З'-концом праймера облегчены, но в то же время всегда доминирует взаимодействие субъединицы р70 с однонитевой платформой бреши, в особенности на ее 5'-конце.
Контакты р14 субъединицы с ДНК в составе полной молекулы. RPA не были обнаружены.Возможно, что эта субъединица закрыта от контактов с ДНК двумя другими полипептидами RРА. По-видимому, р14 выполняет роль полипептида, структурно организующего гетеротример RРА, однако его точная роль в структуре RРА остается неясной.
Таким образом, взаимодействие RРА с ДНК может быть рассмотрено как многостадийный процесс, в ходе которого RPA взаимодействует с участком 8-10 н. и это связывание осуществляется с помощью ДНК-связывающих доменов А и В субъединицы р70. Такое взаимодействие RРА осуществляет, по-видимому, находясь в глобулярной форме. При наличии более протяженного участка однонитевой структуры ДНК RРА изменяет свою конформацию, что делает возможным взаимодействие с ДНК другого домена субъединицы р70 - домена С, а затем и ДНК-связывающего домена (D) субъединицы р32. Такой тип связывания RРА может быть осуществлен в его "вытянутой" конформации, в том случае, когда участок однонитевой ДНК достигает размера около 30 н. RРА в таком комплексе проявляет свое максимальное сродство к однонитевой ДНК. Возможно, что такое расположение ДНК-связывающих доменов обеспечивает возможность более легкого "вытеснения" RРА при заполнении однонитевых брешей в ходе синтеза ДНК ДНК-полимеразами.
Белок RРА (в нефосфорилированной форме) стимулирует полимеразную активность и увеличивает процессивность ДНК-полимеразы α. Фосфорилирование RРА, а также мутации в N-концевой области субъединицы р32 предотвращают взаимодействие белков и активацию ДНК-полимеразы α.
В ходе клеточного цикла уровень фосфорилирования RРА меняется и носит регуляторный характер. Участки фосфорилирования RРА находятся в N-концевом фрагменте субъединицы 32 кДа. При повреждающих воздействиях на клетку, типа УФ-облучения, происходит гиперфосфорилирование RРА, которое коррелирует с подавлением репликации ДНК.
RFC
В процессе репликации крайне важно взаимодействие с ДНК и другого фактора репликации - репликативного фактора С. RFС представляет собой гетеропентамер, состоящий из субъединиц 140-145, 40, 38, 37 и 36 кДа, он обладает АТРазной активностью, стимулируемой ДНК и РСNА. Все пять субъединиц этого фактора содержат в С-концевой области консервативные РСNА-связывающие участки. Этот фактор способствует посадке на ДНК PCNA, и таким образом образуется тройной комплекс RFС • РСNА • Ро1δ- холоэнзим, обеспечивающий процессивный синтез ДНК.
RFC взаимодействует преимущественно с 5'-концом праймера, но не с его З'-концрм. ДНК-связывающий участок RFС локализован на субъединице р140, поскольку именно эта субъединица обнаруживается в качестве продукта ковалентного присоединения к 5'-концу праймера. Существует модель переключения синтеза ДНК от Ро1α к синтезу, катализируемому РСNА-зависимыми ДНК-полимеразами. Согласно этой модели, Ро1α начинает синтез праймера на однонитевой ДНК, покрытой молекулами RРА. RFС связывается с 5'-концом только что синтезированного праймера и блокирует синтез ДНК, выполняемый Ро1α, в тот момент, когда она синтезировала РНК-ДНК-праймер длиной 30 н. На этой стадии репликативный белок С, возможно, способствует посадке РСNА на ДНК. Это приводит к вытеснению Ро1α с З'-конца растущей цепи и синтез продолжается с помощью Роl δ или ε. Схема этого процесса показана на рис….
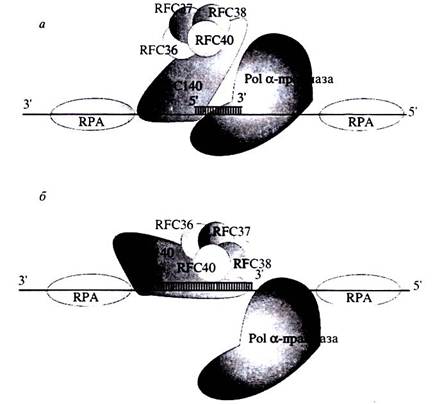
Рис… Роль RFC в репликации ДНК
PCNA
Три молекулы РСNА (36 кД) образуют кольцевой тример с отверстием для двунитевой ДНК в центральной части, который представляет собой перемещающуюся по ДНК подвижную платформу или "скользящий зажим" ("sliding clamp") в форме тора (бублика), удерживающую ДНК-полимеразу δ в ходе полимеризации на матрице и обеспечивающую высокопроцессивный синтез ДНК. Структура этого тора показана на рис…. Хотя РСNА и прокариотический фактор процессивности - субъединица β ДНК-полимеразы III Е. соli - имеют низкую гомологию на уровне первичной структуры, оба белка формируют близкие по пространственной геометрии структуры "скользящей скрепки".
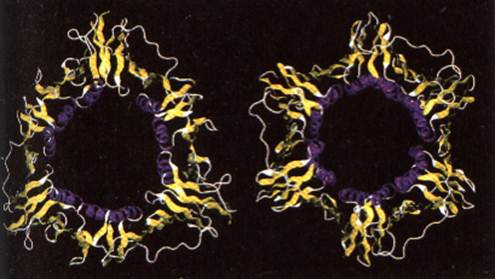
Рис….. Строение PCNA
РСNА стабилизирует комплекс ДНК-полимеразы δ с праймер-матрицей, предотвращает преждевременную диссоциацию фермента и тем самым обеспечивает высокую процессивность синтеза. Однако при этом РСNА способствует фиксации в новообразованной ДНК ошибочно включенных природных и модифицированных нуклеотидов. Фосфорилирование РСNА-связывающего домена RFС, вероятно, является способом регуляции РСNА-зависимого синтеза ДНК, осуществляемого ДНК-полимеразой δ (и ε). Фосфорилирование РСNА-связывающего домена RFС Са2+-кальмодулин-зависимой протеинкиназой II (СаМКII) ингибирует связывание РСNА с RFС и, как следствие, подавляет РСNА-зависимый синтез ДНК, катализируемый ДНК-полимеразами δ и ε. С другой стороны, RFС в комплексе с РСNА и ДНК недоступен для фосфорилирования СаМКП. По другим данным, фосфорилирование РСNА-связывающего домена в большой субъединице (145 кДа) RFС, блокирующее связывание РСNА, может осуществляться при участии циклин-зависимых киназ, регулирующих клеточный цикл. Многие белки, учавствующие в ДНК-метаболизме, имеют сайты связывания с PCNA. Среди них лигаза I, метилтрансфераза для поддерживающег метилирования вновь синтезированной ДНК, некоторые гликозилаы, р21, флэп-эдонуклеаза I (FENI). То есть PCNA служит для сборки комплекса репликации и может привлекать к нему специфические белки в зависимости от конкретных условий.
 2015-04-12
2015-04-12 2236
2236








