Многие известные теперь детали процесса репликации ДНК удалось установить благодаря исследованию поведения и активности ферментов, обеспечивающих работу аппарата репликации. Наиболее полно изучен механизм репликации бактериальной ДНК, особенно ДНК Е.соliи бактериофагов, которые в ней размножаются. Довольно хорошо известны и ферменты репликации дрожжей, Drosophila, млекопитающих.
ДНК-полимеразы.
ДНК-подимсразы присутствуют во всех прокариотических и эукариотических клетках. Более того, многие вирусы бактерий и животных индуцируют образование вирус-специфических ДНК-полимераз или белков, способствующих эффективному участию ДНК-полимераз клеток-хозяев в репликации вирусной ДНК. Многие прокариотические и эукариотические ДНК-полимеразы выделены в чистом виде, а их физические и ферментативные свойства детально охарактеризованы. И хотя эти свойства не совсем идентичны, механизм катализа для всех указанных ферментов в общих чертах одинаков. В первичной структуре ДНК-полимераз эукариот присутствуют консервативные мотивы, гомологичных соответствующим мотивам прокариотических ферментов. Это подтверждает, что все ДНК-сиитерирующие ферменты имеют общий план строения. Общий принцип строения ДНК-полимераз показан на рис. По форме ДНК-полимсразы можно уподобить полураскрытой кисти правой руки, в которой ладонь, большой палец и остальные пальцы представляют три основных пространственных домена и формируют полость, удерживающую ДНК-матрицу и затравку в ходе синтеза. Консервативные мотивы А, В и С образуют активный центр в домене "ладони", "пальцы" удерживают однонитевую матрицу, а "большой палец" "прижимает" праймер - матричный двунитевой участок. Применительно к различным типам ДНК-полимераз эукариот эта модель может быть модифицирована.
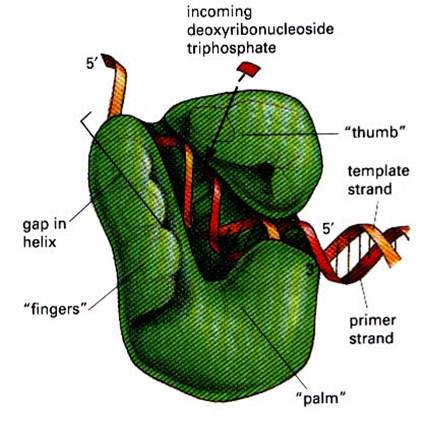
Рис. Общий принцип строения ДНК-полимераз.
ДНК-полимеразы работают совместно с различными белковыми комплексами, удерживающими их в вилке репликации. Чаще всего их называют «зажим и загрузчик зажима».
«Зажим» держит полимеразу на матрице все то время, что идет синтез, но быстро отпускает, как только реакция доходит до района двунитевой ДНК. Зажим имеет форму кольца, образующегося вокруг двунитевой ДНК. Одна часть кольца связывается с ДНК-полимеразой, а все оно целиком свободно скользит по нити вслед за полимеразой. Образование этого кольца вокруг ДНК происходит при гидролизе АТР и участии специального белкового комплекса, называемого «загрузчиком зажима», который также при участии АТР насаживает зажим в районе соединения праймера и матрицы. После объединения ДНК-полимеразы с зажимом, загрузчик зажима отходит от места реакции, но держится поближе к отстающей нити, чтобы провести загрузку на новом месте объединения праймер-матрица, как только ДНК-полимераза диссоциирует при завершении синтеза предыдущего фрагмента Оказаки. Этот процесс схематически изображен на рис…..Подробно об этих комплексах у эукариот и их роли в репликации будет рассказано ниже.
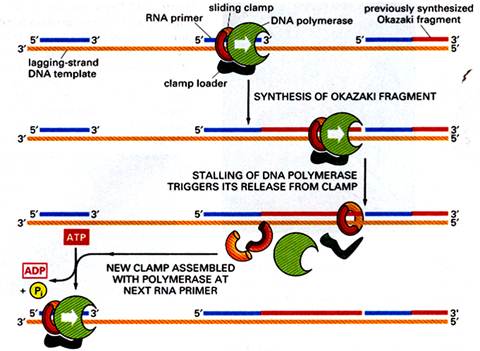
Рис. Загрузка ДНК-полимеразы
ДНК-полимеразы прокариот.
Полимеразы прокариот обозначаются римскими цифрами (в отличие от полимераз эукариот, которые обозначаются греческими буквами). Наиболее полно научена ДНК-полимераза I (Ро11) Е.соli. Она представляет собой одиночный полипептид с мультифуикциональными активностями. В качестве ДНК-полимеразы Ро11 катализирует перенос 5'-дезоксинуклеотидильных единиц дезоксинуклеозид-5'-трифосфатов к З'-ОН-группе в цепи ДНК или РНК. после чего происходит спаривание перенесенного основания с соответствующим основанием комплементарной цепи ДНК. Таким образом, для полимеризации ферменту необходимы праймер в качестве акцептора дезоксинуклеотида и матрица, определяющая присоединение нужного нуклеотида. Помимо полимеризации нуклеотидов, Ро11 катализирует две другие реакции, биологическая роль которых очень важна. В одной из них происходит гидролиз фосфодиэфирных связей в одной цепи ДНК или на неспаренном конце дуплексной ДНК, причем за один акт удаляется один нуклеотид, начиная с 3'-конца цепи (3'-5'- экзонуклеяза).Вторая реакция также состоит в отщеплении нуклеотидов, но гидролиз начинается с 5'-конца дуплексной ДНК в направлении к З'-концу (5'-3'-экзонуклеаза).Эти различные активности присущи разным сайтам полипептидиой цепи РоlI, Если in vitro обработать РоlI трипсином, то полипептидная цепь расщепится на большой и малый фрагменты. Большой, С-концевой фрагмент («фрагмент Кленова») сохраняет ДНК-полимеразную и 3' -5'-экзонуклеазную активности; малый, N-концевой фрагмент обладает только 5'-3'-экзонуклеазноЙ активностью.
РоlI и присущие ей экзонуклеазные активности играют очень большую роль в репликации и репарации хромосомной ДНК Е.соli. 3’- 5'-экзонуклеазная активность обеспечивает контроль за присоединением каждого нуклеотида и удаление ошибочных нуклеотидов вновь синтезированной цепи. Если эта активность подавлена в результате каких-то мутаций в гене, кодирующем РоlI, то при репликации генома часто происходят мутации - замены оснований.
Способность ДНК-полимеразы удлинять З'-конец цепи, спаренной с матричной цепью, позволяет ей заполнять пробелы между сегментами отстающей цепи. РоlI удлиняет фрагменты Оказаки с 3'-концов и удаляет рибонуклеотиды, с которых начинаются 5'-концы соседних фрагментов, что является необходимой предпосылкой для формирования непрерывной отстающей цепи. Поскольку РоlI способна удлинять 3'-конец одной из цепей в месте разрыва в двунитевой ДНК и удалять нуклеотиды с 5'-конца того же разрыва (процесс, называемый ник-трансляцией ), этот фермент играет ключевую роль в репарации поврежденной ДНК. Ник-трансляция широко используется in vitro для синтеза радиоактивно меченой ДНК.
У Е. соli имеются и две другие ДНК-полимеразы, но они присутствуют в клетке в меньших количествах. РоШ присоединяет нуклеотиды значительно менее эффективно, чем Ро11, и не обладает 5'- З'-экзонуклеазной активностью. Следовательно, РоШ может заполнять пробелы между фрагментами ДНК, спаренными с матричной цепью, но не способна отщеплять РНК-нуклеотиды от фрагментов Оказаки или осуществлять ник-трансляцию. Роль РоШ в репликации и сохранении хромосомной ДНК Е.соliдо настоящего момента неясна. Вероятно, она может участвовать в восстановлении синтеза ДНК после повреждения и остановки вилки репликации. Такой процесс принять называть ресинтезом.
Ро1III-холофермент- это ключевой фермент, ответственный за репликацию хромосомной ДНК Е.соli. В каждой клетке содержится только 10-20 копий Ро1Ш-холофермента, но именно он является основным компонентом мультиферментного полимеразного комплекса, инициирующего формирование репликативных вилок в точках начала репликации, участвующего в элонгации лидирующей цепи в вилке и удлиняющего РНК-праймеры с образованием фрагментов Оказаки. Так как РоПП-холофермент не обладает 5'-З'-экзонуклеазной активностью, для репликации отстающей цепи необходимо участие РоlI, чтобы произошло удлинение продукта, образовавшегося при участии РоlIII, и удаление РНК-праймеров на 5'-конце фрагментов Оказаки.
Методом направленного мутационного анализа обнаружены изменения в полипептидной цепи основного (кор) фермента Ро1III, и изучены аминокислотные замены, которые позволяют приписать определенные виды ферментативной активности конкретным субъединицам ферментного комплекса. Так, α-субъединица обладает полимеразной активностью, а ε-субъединица - 3' 5'-экзонуклеазной. Однако комплекс α- и ε-субъединиц обладает значительно более высокой полимеразной и экзонуклеазной активностями, чем каждая из соответствующих субъединиц в отдельности. Функция третьей, θ-субъединицы пока неясна.
Помимо субъединиц, составляющих РоПП-кор, Ро1III-холофермент содержит еще семь субъединиц: τ,γ,β,δ,δ’,χ, и ψ. Перечисленные полипепгиды также существуют во множестве копий, так что в результате мол. масса полимеразного комплекса составляет примерно 103 кДа. Роль β-субъединицы заключается в том, чтобы свести к минимуму вероятность отделения фермента от матрицы до завершения процесса копирования, то есть работает как «зажим». Точная же функция других субъединиц неизвестна. Вполне возможно, что Ро1 Ш-холофермент существует в двух формах, каждая из которых содержит определенный набор вспомогательных субъединиц, придающих ферменту определенные свойства. В одной форме фермент катализирует синтез непрерывной ведущей цепи, а в другой - прерывистой отстающей.
Ро1III-холофермент катализирует же реакции синтеза, что и Ро1I, но работает примерно в 60 раз быстрее. Более того, Ро1III-холофермент обладает повышенным сродством к матрице и обеспечивает более высокую эффективность копирования. Ро1III-холофермент может связываться и с другими белками, увеличивая эффективность процесса копирования благодаря координации некоторых важных ферментативных этапов репликации. На этом более высоком уровне организации в комплексы могут включаться белки, расплетающие спираль ДНК в точках начала репликации и в репликативных вилках (геликазы), инициирующие образование праймерных РНК (праймазы), обеспечивающие последовательное наращивание цепей ДНК, терминирующие процесс репликации и разделяющие дочерние спирали ДНК.
ДНК-полимеразы, синтезируемые другими бактериями и многими бактериофагами, различаются по своим физической структуре и свойствам. Тем не менее, катализируемые ими реакции практически идентичны реакциям, изученным у Е.соli. У всех ДНК-полимераз есть корректирующая 3'- 5'-экзонуклеаза, однако 5'- З'-экзонуклеаза у большинства ферментов отсутствует. Например, ДНК-полимераза фага Т4 может осуществлять 3'~ 5'-экзонуклеазную реакцию и корректировать ошибки репликации, но не способна катализировать 5'- З'-экзонуклеазную реакцию и поэтому не может обеспечить ник-трансляцию. При репликации ДНК фага Т4 5'-З'-экзонуклеазную реакцию удаления РНК-праймеров перед объединением фрагментов Оказаки катализирует другой кодируемый фагом белок. В процессе прерывистого синтеза отстающих цепей и репарации повреждений ДНК фага Т4 этот фермент работает согласованно с фаговой ДНК-полимеразой. Некоторые вирусы животных (например, герпесвирус, вирус коровьей оспы и вирус гепатита) индуцируют синтез особых полимераз для репликации своих геномов.
Другие вирусы образуют белки, которые стимулируют системы репликации клеточной ДНК или участвуют в репликации вирусной ДНК. Например, паповавирусы синтезируют белки, необходимые для инициации репликации. Аденовирусы человека кодируют белки, «запускающие» инициацию синтеза обеих цепей линейной вирусной ДНК. Они продуцируют также особые ДНК-связывающие белки, облегчающие репликацию.
ДНК-полимеразы эукариот.
В эукариотических клетках идентифицировано множество ДНК-полимераз, но их физические и функциональные свойства изучены менее детально, чем у соответствующих ферментов прокариот.
Точная пространственная структура, определенная с помощью рентгеноструктурного анализа, известна лишь для одной ДНК-полимеразы эукариот - полимеразы β-типа, которая заметно отличается по строению от других ДНК-полимераз эукариот.
Сводные данные об основных полимеразах эукариот приведены в таблице….
| ДНК-полимераза | Дополнительная активность | Субъединицы (кДа) | Локализация, функция |
| α (альфа) | ДНК-праймаза Точность 102 | 165-180 48- 50, 55-60 | Ядро, репликация (инициация в районе ori и фрагментов Оказаки) |
| β (бэта) | dRp-лиаза 103 | 38-40 | Ядро, репарация |
| γ (гамма) | 3’→5’ экзонуклеаза, dRp-лиаза 104 | 125-140 35-50 | Митохондрии, репликация и репарация |
| δ (дельта) | 3’→5’ Экзонуклеаза | 125-130 48-55 (дрожжи: 125, 55, 54, 42, 22) | Ядро, репликация (элонгация лидирующей нити. PCNA-зависимая репарация |
| ε (эпсилон) | 3’→5’ Экзонуклеаза | 261, 55 (дрожжи: 256, 870, 34, 31, 29) | Ядро, репликация (элонгация запаздывающей нити). PCNA-зависимая репарация |
Таблица… ДНК-полимеразы эукариот
ДНК-полимераза α – праймаза
В клетках эукариот синтез ДНК происходит, в основном, в специфических плотных структурах ("репликативных фабриках"), присоединенных к диффузному ядерному матриксу. Предполагается, что в молекулярной организации ядерного матрикса играют некоторую роль фосфолипиды и что ДНК связана с ядерным скелетом гидрофобными взаимодействиями. "Репликативные фабрики", 21S репликативные комплексы, связанны с ядерным матриксом, включают в себя группу ферментов, состоящую не менее чем из 30 белков с молекулярной массой от 15 до 300 кДа, и содержат помимо ДНК-полимеразы α -праймазы еще и 3'-5'-экзонуклеазу, ДНК-лигазу I, РНКазу Н, ДНК-топоизомеразу I, ДНК-геликазу, РСNA и ряд других факторов. Также этот комплекс содержит RРА, специфически взаимодействующий с субъединицей р48 комплекса полимераза-праймаза. Значительный запас ДНК-полимеразы α накапливается в яйцеклетках иглокожих, амфибий, костистых рыб и дрозофилы для обеспечения интенсивной репликации ядерной ДНК в ходе раннего развития.
Как правило, ДНК-полимеразы α не обладают корректорской 3' — 5'-экзонуклеазной активностью. Однако в каталитической субъединице 182 кДа ДНК-полимеразы α дрозофилы обнаружена 3' — - 5'-экзонуклеаза, проявляющая активность только при диссоциации субъединицы 73 кДа.
Мультибелковая форма ДНК-полимеразы α содержит также белок, который связывает динуклеотиддиаденозинтетрафосфат (Ар4А). Предполагается, что Ар4А участвует в репликации ДНК и клеточном делении. Имеются данные о способности ДНК-полимеразы α использовать Ар4А в качестве праймера. Однако участие Ар4А в качестве праймера in vivoмаловероятно, скорее он используется как эффектор. Интересно, что триптофанил-тРНК-синтетаза, синтезирующая этот динуклеотид, находится в том же мултибелковом комплексе.
Обычно комплекс праймаза-полимераза α состоит из четырех субъединиц: большой субъединицы с молекулярной массой 180 кДа, или семейства полипептидов с размерами от 140 до 160 кДа; субъединицы с молекулярной массой 70 кДа и двух малых субъединиц с молекулярными массами 54-58 и 46-50 кДа. Субъединица р180 отвечает за полимеразную функцию. С двумя малыми субъединицами связана праймазная активность. При этом субъединица 48 кДа является каталитической и непосредственно осуществляет праймирование ДНК, а субъединица 58 кДа участвует в связывании инициирующего пуринового нуклеотида и присоединении субъединицы р48 к ДНК-полимеразе α. Она также влияет на скорость полимеризации и стабильность продукта, синтезируемого субъединицей 48 кДа. р58 также облегчает проникновение р48 из цитоплазмы в ядро. Субъединица р180 непосредственно взаимодействует с р58.
С каталитической субъединицей связана субъединица 68-70 кДа, которая необходима для транспорта каталитического полипептида в клеточное ядро. Субъединица 68-70 кДа участвует также в регуляции уровня ДНК-полимеразы α в клетке, она стимулирует синтез каталитического полипептида. Хотя комплекс ДНК-полимераза α-праймаза состоит из четырех субъединиц, количественный состав этого комплекса может быть различным. Вероятно, полимераза α и праймаза находятся в "коре" в соотношении 1: 3.
 2015-04-12
2015-04-12 4433
4433
