Для того, чтобы выполнять все многочисленные функциипо поддержанию геномной стабильности, теломерная ДНК должна функционировать в комплексе с определенными специфическими белками. Лучше всего они к настоящему времени изучены у человека.
Два главных белка, способных специфически связываться с теломерным повтром ДНК получили названия TRF1 и TRF2 (Теlomeric repeat binding protein 1 и 2) У человека эти белки способствуют образованию гигантской теломерной петли (t-петля), размеры которой у человека сопоставимы с размерами теломер.
Первое сообщение о белке TRF 1 было опубликовано в 1992 г. В 1997 была определена его аминокислотная последовательность и показано, что есть два несколько различающихся по размеру белка, являющихся продуктами альернативного сплайсинга. Меньший получил нащзвание Pin1. Доменная структура ТRF1-2 и устройство Т-петли схематически представлена на рис…. На С-конце этой молекулы имеется ДНК-связывающий модуль типа Муb. Чтобы белок взаимодействовал с нуклеиновой кислотой, необходима олигомеризация полипептидов, для которой служит ТRF домен. По данным электронной микроскопии, тетрамер ТRF1 с высокой специфичностью связывает до 12 теломерных повторов ДНК позвоночных, но не теломер растений или нематоды. Не активен ТRF1 и в отношении однонитевой ДНК, расположенной на конце теломер человека. В насыщаюшей концентрации этот белок покрывает теломеры как сплошная оболочка 10-нм толщины. Каждая молекула ТRF1 изгибает ДНК под утлом около 1200. В последовательности ДНК белок связывает два сайта 5'-YTАGGGТТR-3', которые могут быть расположены на разном расстоянии и под разным углом, в связи с чем предполагается, что ДНК-связывающие участки ТRF1 связаны с остальной частью белковой молекулы регионами, обладающими повышенной эластичностью.
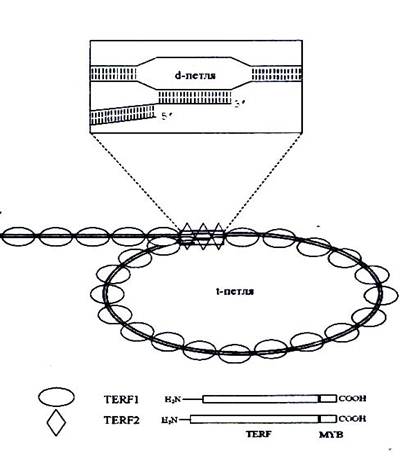
Рис… Схема строения Т-петли и белков TRF1,2 у человека
Белок ТRF2 был найден в конце 90-х годов. По структуре он сходен с ТRF 1, но ТRF домен последнего не взаимодействует с гомологичным доменом второго представителя данного семейства, так что оба белка в клетке могут существовать в виде гомо-, но не гетеродимеров. У ТRF2, как и у ТRF1, в результате альтернативного сплайсинга образуются два варианта. На теломерах белок ТRF2 связывается в существенно меньшем количестве, чем ТRF1. Регион, в котором концентрируется этот белок, был уточнен с помощью электронной микроскопии. Оказалось, что ТRF2 расположен в узле, образующемся в точке касания конца теломер со «стволом». Тогда же впервые обнаружили, что ингибирование ТRF2 может приводить к активации АТМ/р53-зависимого пути ответа клетки на повреждение ДНК и затем к апоптозу, поскольку незащищенные теломерным белком концы хромосом подобны двунитевым разрывам ДНК.
Теломерные петли были обнаружены на хромосомах клеток НеLа, периферических лейкоцитов человека, первичных клеток печени мыши, а также на теломерах трипаносом и на микроядерных, но не макроядерных хромосомах инфузории Oxitricha. Размеры t-петель в клетках человека составляют от 5 до 40 тыс. пар оснований. У трипаносом t-петли сравнительно небольших размеров, около 1 тыс. пар оснований, хотя теломеры у этих простейших и у человека сравнимы по длине. По-видимому, это минимальные размеры t-петель, наблюдавшихся на сегодняшний день.
Для связывания ТRF2 на конце хромосомы необходим однонитевой участок теломерной ДНК длиной не менее одного повтора из шести нуклеотидов ТТАGGG. Наличие более одного повтора в однонитевом участке улучшает связывание. Добавленный в избытке этот белок связывается на теломерах в количестве не менее трех, а в среднем около десяти димеров.
Предполагают, что в этом участке З'-концевая одноцепочечная ДНК гибридизована с антипараллельной цепью частично расплетенной двойной спирали «ствола», так что образуется так называемая d-петля (displacement 1оор) иди соединение типа структуры Холлидея.
Строение Т-петли подробно показано на рис….
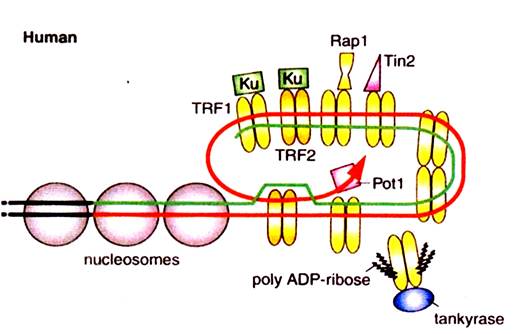
Рис. ….Строение Т-петли у человека
Открытие и изучение теломерных белков дало дополнительную информацию о роли теломер в регуляции клеточного старения.
В функциональных исследованиях белков ТRF выяснилось, что резкое увеличение концентрации ТRF1 при его экспрессии в культуре клеток под вирусным промотором приводит к преждевременному вступлению в митоз и последующей гибели клетки.. В аналогичных условиях ингибирование ТRF1 в клетках, экспреccирующих теломеразу, сопровождается медленным увеличением длины теломер. Очевидно, ТRF1, способствуя образованию t-петли, тем самым препятствует удлинению теломер за счет теломеразной активности. Показано также, что ТRF1 in vitroподавляет удлинение С-цепи теломер.
Совсем иначе проявляются последствия экспериментального воздействия на белок ТRF2. Его ингибирование с помощью доминантно негативных делеционных мутантов приводит к немедленному и необратимому прекращению пролиферации, к морфологическим изменениям в строении модельных клеток, напоминающим старение и к индукции в них характерных для клеточного старения молекулярных маркеров. Хромосомы таких клеток часто сливаются концами и образуют кольцевые структуры, хотя и не теряют теломерные повторы. В то же время на концах уцелевших теломер исчезают однонитевые участки, хотя активность теломеразы, достраивающей одну из цепей, не изменяется. Таким образом, не теломеры сами по себе защищают хромосомы от нуклеаз, слияния и последующих разрывов при митозе. Это функция белка ТRF2.
Увеличение концентрации ТRF2 в первичной культуре фибробластов сопровождается некоторым возрастанием скорости укорочения теломер в ходе старения клеточной популяции. В то же время этот эффект не приводит к преждевременному старению: напротив, в ходе эксперимента клетки продолжают пролиферировать, когда контрольная культура уже прекращает расти. Пороговая для репликативного торможения пролиферации длина теломер у контрольных клеток составляет 6—7 тыс. пар нуклеотидов. У экспериментальной культуры, экспрессирующей большое количество ТRF2, эта точка на 2—2,7 тыс. пар оснований ниже, что позволяет им пройти еще около 15 делений, прежде чем наступает старение. Более того, в клетках с критически короткими теломерами. сенильных или мутантных по р53 и Rb, повышенная экспрессия ТRF2 предотвращает слияния и разрывы хромосом. Полученные данные можно интерпретировать следующим образом: не длина теломер важна для индукиии клеточного старения, а их состояние, связанное с защитной функцией белка ТRF2. Например, сенильные теломеры могут быть недостаточно длинными для кепирования конца хромосомы в узловой точке t-петли, но когда концентрация ТRF2 повышена, то вероятность образования нормальной t-петли возрастает.
Известно, что онкобелки некоторых вирусов позволяют соматическим клеткам преодолеть пролиферативные барьеры и делиться бесконечно долго. В экспериментах на первичной культуре фибробластов было показано, что ингибирование ТRF2 не только приводит к фенотипическим изменениям, характерным для старения, как это ранее наблюдалось на клетках фибросаркомы, но также сопровождается характерными для старения генетическими изменениями. В частности, экспрессия доминантно негативного аллеля ТRF2 сопровождается частым слиянием хромосом, формированием во многих клетках более двух центросом и тетраплоидного кариотипа. После ингибирования ТRF2 в клетках активирован р53, гипофосфорилирован Rb, увеличена концентрация р16 и понижен уровень циклина А, что характерно для клеточного старения. Одновременная инактивация р53 и Rb при помощи Т-антигена вируса SV40 и другими способами предотвращает старение экспериментальных клеток, вызванное ингибированнемТRF2. Эти эксперименты вновь указывают, что белки р53 и Rb, индуцирующие старение могут быть активированы теломерами, когда они не защищены белком ТRF 2. Схема взаимодействия этих белков представлена на рис….
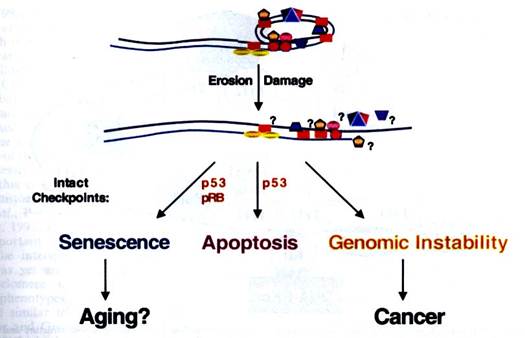
Рис…..Роль Т-петли в индукции клеточного старения и апптоза
Интересно, что р5З имеет повышенное сродство к однонитевому участку теломер, к узловому региону t-петли и даже несколько повышает вероятность образования t-петли в присутствии ТRF2.
Уточнение состава теломерного нуклеопротеидного комплекса и выяснение роли теломерных белков в индукции клеточного старения позволяет перейти к исследованию естественных регуляторов состояния теломер. Кроме уже давно известной теломеразы, за последние годы было найдено еще несколько белков, которые могли бы играть подобную роль.
Хотя влияние ТRF2 на теломеры в условиях эксперимента проявляется наиболее отчетливо, его модуляторы практически неизвестны. Лишь белок hRap1(repressor-activator protein) был недавно идентифицирован как партнер ТRF2, преимущественно связываемый на теломерах, хотя он может также взаимодействовать с некоторыми другими участками хромосом. Зато активность ТRF1. относительно мягко изменяющего длину теломер, может регулироваться in vivoнесколькими различными способами.
Например, ТRF1 может быть поли-АDР-рибозилирован, что сопровождается его диссоциацией от ДНК. Эту посттрансляционную модификацию катализирует танкираза (теломерная анкириновая поли-АDР-рибоза-полимераза), белок, проникающий в ядро в неактивном состоянии связанный с TRF1. После активации танкираза подвергает поли-АDР-рибозилированию себя и ТRF1, что приводит к распаду нуклеопротеидного комплекса и освобождению теломер. В результате теломеры становятся доступными для теломеразы и других ферментов, в связи с чем танклразу считают позитивным регулятором теломеразы.
У человека и позвоночных животных имеется два изозима танкиразы, несколько различающихся по молекулярной массе (142 и 127 кДа в немодифицированном состоянии), называемые ТNKS или танкираза 1 и ТNKL или танкираза 2. Кроме энзиматического домена, гомологичного соответствующему домену РАRР, у танкиразы имеется большой анкириновый домен, состоящий из 24 повторов, а также SАМ домен, участвующие в различных белок-белковых взаимодействиях. У танкиразы 1 в отличие от танкиразы 2 имеется также дополнительный N-концевой домен, функция которого до сих пор не ясна. Ни одна из таекираз не имеет собственного сигнала ядерной локализации, поэтому большая часть фермента находится в цитоплазме. Здесь танкираза подвергается фосфорилированию и активации МАР-киназой, хотя пока остается неясным, переносится ли активированный фермент в ядро, или ядерный пул танкиразы активируется МАР-киназой, которая, как известно, сама может быть транслоцирована из цитоплазмы в ядро. МАР-киназа через сигнальный путь Ras-МАРК регулируется инсулином и факторами роста; поэтому следует предположить, что с помощью танкиразы организм держит теломеры всех клеток пол контролем гормонов.
Если танкираза in vivo ингибирует ТRF1, то увеличена активность последнего может быть за счет возрастания концентрации белка, которая наблюдается в поздних стадиях клеточного цикла накануне митоза. По-видимому, ТRF1 необходим для упаковки митотических хромосом, так как экспериментальное увеличение его концентрации, как уже отмечалось выше, провоцирует преждевременный вход в митоз. Чтобы отложить митоз, например, когда ДНК нуждается в репарации, этот белок может быть фосфорилирован протеинкиназой АТМ; той же самой протеинкиназой, которая активирует р53 и индуцирует апоптоз и клеточное старение по р53-зависимому механизму. Если в клетках больных АТМ ингибировать ТRF1, то они смогут поддерживать нормальную длину теломер, которые в больных клетках укорачиваются существенно быстрее, чем в здоровых.
Недавно был найден еще один теломерный белок, взаимодействующий с ТRF1, который называют TINF2 или ТIN2 (ТRF1 intracting nuclear factor 2). Его молекулярная масса -40 кДа. По структуре он напоминает белки ТRF, так как на его С-конце также расположен ДНК-связываюший домен типа Муb. Как и ТRF1, этот фактор способствует укорочению теломер и негативно регулирует активность теломеразы. Например, если в контрольной культуре иммортализованных фибробластов средняя длина теломер входе эксперимента через 43 удвоения популяции уменьшалась от 6,4 тнп до 5,700 тнп, то при высоком уровне экспрессии TINF2 длина теломер падала до 5 тнп. В том же эксперименте ингибирование ТINF2 путем экспрессии его доминантно негативного мутанта, напротив, привело к удлинению теломер до 9 тнп. Считается, что ТINF2 опосредует действие ТRF1.
Механизм действия ТRF1 на теломерах вряд ли заключается только в закручивании ДНК в сулерспираль и облегчении последующего образования t-петли. как было указано выше. Благодаря взаимодействию с множеством регупяторных белков, ТRF1 может концентрировать их в области теломер. В частности, ТRF1 связывает мощный ингибитор теломеразы, белок РinX1, который действует непосредственно на фермент, в отличие от остальных ранее упоминавшихся модуляторов, влияющих на доступность субстрата теломеразы, т.е. теломер. Совсем недавно был обнаружен еще один теломерный белок, связывающийся на однонитевом участке, Роt1. Вероятно, функция этого 71 кДа полипептида состоит в защите особенно уязвимой со стороны нуклеаз, облучения и химических агентов однонитевой ДНК, чем и объясняется его название (Protection of telomeres, РОТ). Роt1 взаимодействует с ТRF1. Предполагают, что, влияя на связывание Роt1, белок ТRF1, концентрация которого пропорциональна длине теломер, передает на однонитевые концы информацию об обшей протяженности теломерной ДНК.
Возможно, упомянутыми здесь белками список различных компонентов теломерного нуклеопротеидного комплекса, называемого также телосомой, не исчерпывается. В следующем разделе будут приведены дополнительные данные, указывающие на наличие еще не исследованных теломерных белков и белков, ассоциированных с теломерами структурно и/или функционально.
 2015-04-12
2015-04-12 2929
2929
