Несмотря на то, что молекулярная структура теломеры была к началу 90-х гг. в основном охарактеризована, проблема неполной репликации на конце линейной молекулы ДНК осталась.
Было показано, что укорочение теломер у человека непостоянно и имеет свою возрастную динамику. В первичной культуре фибробластов, растущих in vitro, каждое удвоение количества клеток сопровождается уменьшением теломер на 48 ± 21 пар нуклеотидов, а
фибробласты человека in vivo имеют среднюю величину укорочения теломер равной -75 пар оснований на один акт митоза. Теломеры периферических клеток крови детей до 4 лет теряют более 1000 пар нуклеотидов в год, в возрасте от 4 до 20 лет укорачиваются все медленнее, а в зрелом и пожилом возрасте их длина падает с практически постоянной скоростью около 30—60 пар нуклеотидов ежегодно. Критическая длина теломер фибробластов человека при которой наступает репликативное старение (торможение и полное прекращение пролиферации), не более 5 -7 тыс. пар оснований
Размеры теломер у разных видов, разных особей в популяции любого вида, в разных клетках одного и того же организма и даже на разных хромосомах одной и той же клетки или на разных плечах одной и той же хромосомы могут различаться в несколько раз, но обычно составляют от нескольких тысяч до нескольких десятков тысяч пар оснований. Одна из цепей теломерной ДНК длиннее комплементарной цепи и образует участок З'-концевой однонитевой ДНК на концах теломер, длина которого может превышать двести нуклеотидов.
В 1985 г. Грейдер и Блэкберн выяснили, что природа выработала механизм удлинения (элонгации) самого конца хромосомы, т. е. теломерного концевого повтора. Это связано с активностью особого фермента - теломеразы. Это рибонуклеопротеид, он содержит короткую молекулу РНК (примерно 150 нуклеотидов, среди которых 2 копии теломерного повтора 5'-СААССС-3').
Перед началом цикла репликации ДНК теломераза добавляет несколько копий теломерных повторов на З'-конец ДНК. После этого репликация идет в обычном порядке. На отстающей цепи синтезируются РНК-праймеры, при этом наиболее важно то, что концевой праймер синтезируется на теломерном повторе. После завершения репликации остается незаполненным только участок РНК-праймера, синтезированного на теломерной последовательности. В результате кодирующие части дочерних цепей ДНК получаются той же длины, что и родительских.
Часть нуклеотидов на З'-конце отстающей цепи все же не будет реплицироваться. Но эта неполная репликация произойдет в зоне теломерного повтора, что не причинит никакого вреда генам, расположенным рядом.
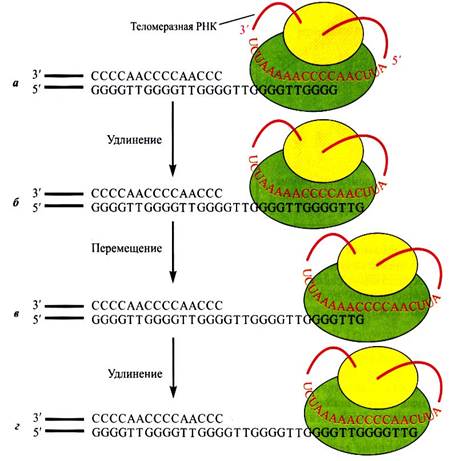
Однако через несколько циклов репликации теломерный повтор «растает» и недорепликация начнет затрагивать гены. Поэтому второй функцией теломеразы является постоянное наращивание С-нити. Теломераза обладает своей молекулой РНК, имеющей матричный участок, с помощью которого фермент распознает теломерный повтор. Последовательность 5'-СААССССАА-3' в составе молекулы теломеразы спаривается с последовательностью теломерного повтора 5'-ТТСGGG-3'. Нуклеотиды ААС в РНК теломеразы остаются неспаренными, и на них достраиваются ТТG. Фермент перемещается на самый конец теломерной последовательности, т. е. на всю длину ТТССССТТС, и нук-леотиды ААС из молекулы теломеразной РНК спариваются с ТТС теломерной ДНК, после чего достраивается вся последовательность повтора. Принцип удлинения концевого участка молекулы ДНК у дрозофилы тот же, что и у других видов, это показано на рис…..
Интересно, что теломераза, по-видимому, избирательно удлиняет наиболее короткие теломеры.
Рис…. Работа теломеразы инфузории тетрахимены.
Теломеры в клетках зародышевого пути благодаря постоянно высокой активности теломеразы сохраняют нормальную длину. Однако в соматических клетках, культивируемых in vitro, теломераза неактивна и теломеры постоянно укорачиваются. Этим можно объяснить существование лимита Хейфлика. В раковых клетках, которые также являются соматическими, клеточные деления не прекращаются и теломеры не укорачиваются. Оказалось, что почти во всех образцах опухолевых клеток, взятых как из культуры, так и из целого организма, активность теломеразы сохраняется на высоком уровне.
В последнее время накапливаются данные о том, что нарушения в механизме удлинения теломерного повтора непосредственно связаны с формированием злокачественных новообразований, а также играют важную роль в процессе старения. Искусственное удлинение теломер путем экспрессии теломеразы позволяет предотвратить старение и получить иммортализованную клеточную линию. Так же преодолевают старение спонтанно иммортализуюшиеся опухолевые клетки: они либо начинают экспрессировать теломеразу, либо поддерживают на стабильном уровне длину теломер альтернативными способами. Ингибируя теломеразу, в ряде случаев можно прекратить рост культуры раковых клеток.
 2015-04-12
2015-04-12 3396
3396
