Окислительно–восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления элементов. Степень окисления (окислительное число) – заряд атома, вычисленный исходя из условного предположения, что все связи в молекуле являются ионными.
При определении степени окисления необходимо учитывать, что алгебраическая сумма окислительных чисел всех атомов, входящих в состав молекулы, равна нулю. Например, необходимо определить окислительные числа кремния и фосфора в соединениях H2SiO3 и K4P2O7:
| H2+1SixO3–2 | K4+1P2xO7–2 |
| +2+Х+(–2*3)=0 | +4+2Х+(–2*7)=0 |
| Х=4 | Х=5 |
Степень окисления обозначается арабскими (иногда римскими) цифрами с предшествующими знаками ²+² или ²–². Таким же образом, но со знаком после цифры, обозначаются заряды ионов.
Например:
| Na+, Zn2+, Fe3+, NO3–, SO42–, PO43– | (обозначение заряда ионов) |
| Zn+2Cl2–, H2+1S+6O4–2, K2+1Cr2+6O7–2 | (обозначение степени окисления) |
Окисление – процесс отдачи электронов атомом, молекулой или ионом:
| 2Cl– – 2ē = Cl2; | Fe2+ – ē = Fe3+; | Si – 4ē = Si+4 |
При этом степень окисления атома повышается.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом:
| Cl20 + 2ē = 2Cl–; | Fe3+ + ē = Fe2+. |
При этом степень окисления атома понижается.
Окисление и восстановление – процессы сопряженные: отдача электронов всегда сопровождается их присоединением
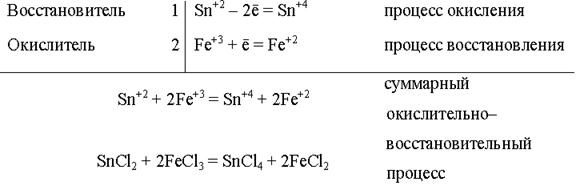
В реакциях число принятых окислителем и отданных восстановителем электронов должно быть одинаково.
В методе ионно–электронного баланса учитывается, что отдают и принимают электроны ионы или молекулы. При этом может изменяться не только заряд, но и состав частиц.
Например, переходы
| NO2– ® NO3–; | MnO4– ® MnO2 | |
| SO32– ® SO42–; | P ® PH3 | и т.п. |
сопровождаются потерей или присоединением атомов кислорода или водорода.
Такие взаимные переходы возможны только с участием частиц среды, присутствующих в растворах: в кислой среде – Н+ и Н2О, в нейтральной – Н2О, в щелочной – ОН– и Н2О.
Участие частиц среды в переносе кислорода в ОВР.
| рН среды | Акцептор кислорода | Донор кислорода | Схема процесса | ||
| рН < 7 | Н+ | Н2О | 2Н+ | 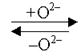 | Н2О |
| рН > 7 | Н2О | ОН– | 2О Н– | 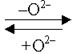 | Н2О |
| рН = 7 | Н2О | Н2О | Н2О |  | 2ОН– |
| Н2О |  | 2Н+ |
Рассмотрим пример реакции, протекающей в кислой среде.
Даны исходные вещества:
KMnO4 + Na2SO3 + H2SO4 ®
1. Определяем степени окисления элементов, находим окислитель, восстановитель и рН среды:
KMn+7O4 – окислитель (Mn находится в высшей степени окисления +7),
Na2S+4O3 – восстановитель (S находится в промежуточной степени окисления, равной +4),
H2SO4 – среда кислая (рН<7).
2. Записываем левую часть уравнения в виде ионов, учитывая только ионы, содержащие окислитель и восстановитель, а также ионы, обеспечивающие реакцию среды:
MnO4– + SO32– + H+ ®
3. Записываем схему возможных полуреакций для процессов окисления и восстановления:
| MnO4– ® Mn2+ | (процесс восстановления) |
| SO32– ® SO42– | (процесс окисления) |
4. Составляем полуреакции:
а) уравниваем число атомов элементов и заряды левой и правой частей полуреакций, используя частицы среды и переходы электронов:
MnO4– + 8H+ + 5ē = Mn2+ + 4H2O
SO32– + H2O – 2ē = SO42– + 2H+
в) находим коэффициенты:
| MnO4– + 8H+ + 5ē = Mn2+ + 4H2O | |
| SO32– + H2O – 2ē = SO42– + 2H+ |
5. Суммируем две полуреакции с учетом коэффициентов и получаем сокращенное ионное уравнение:
2MnO4– + 16H + + 5SO32– + 5H2O = 2Mn2+ + 8H2O + 5SO42– + 10H +
Сокращаем подобные члены:
2MnO4– + 6H+ + 5SO32– = 2Mn2+ + 3H2O + 5SO42–
6. Дописываем ионы, не принимающие участие в окислительно–восстановительном процессе, с учетом компенсации заряда:
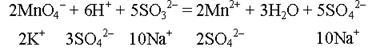
7. Составляем молекулярное уравнение реакции:
2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
В качестве примеров рассмотрим еще две реакции, протекающие в нейтральной и щелочной средах.
Реакция взаимодействия манганата калия с водой (нейтральная среда):
K2MnO4 + H2O ® KMnO4 + MnO2 + KOH
Ион MnO42–, содержащий Мn+6 в промежуточной степени окисления, может выполнять как функцию окислителя, так и функцию восстановителя.
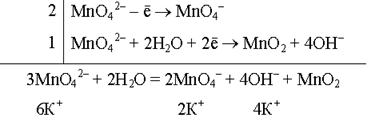
Молекулярное уравнение реакции:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
Реакция взаимодействия кремния с пероксидом водорода в щелочной среде:
Si + H2O2 + KOH ® K2SiO3 + H2O
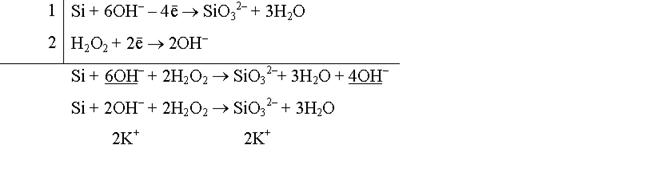 Молекулярное уравнение реакции:
Молекулярное уравнение реакции:
Si + 2KOH + 2H2O2 = K2SiO3 + 3H2O
 2015-04-01
2015-04-01 1619
1619








