1. Из соотношения 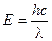 следует, что
следует, что
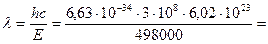 2,40·10–7 м = 240 нм.
2,40·10–7 м = 240 нм.
2. Согласно приведённому механизму, озон образуется по реакции 2, и скорость его образования равна k 2[O][O2][M], то есть пропорциональна концентрациям [O], [O2] и [M]. На очень большой высоте концентрация атомов кислорода O достаточно велика (поскольку велика интенсивность ультрафиолетового излучения), однако концентрации O2 и М очень малы. Напротив, на очень малой высоте, где концентрации O2 и М велики, концентрация атомов кислорода O очень мала (ультрафиолетового излучения для их образования недостаточно).
3. Молекула M поглощает выделяющуюся в реакции 2 энергию. Если бы молекулы M не было, то образовавшаяся молекула озона сразу бы снова распалась.
4. Как сказано выше,защитные свойства озонового слоя объясняются поглощением ультрафиолетового излучения. Энергия света, поглощённая в реакции 3, выделяется в виде кинетической энергии молекул в реакции 2. В результате многократного повторения реакций 2 и 3 энергия поглощённого света преобразуется в кинетическую энергию молекул, что приводит к повышению температуры.
5. Скорости реакций:
r 1 = k 1[O2], r 2 = k 2[O][O2][M], r 3 = k 3[O3], r 4 = k 4[O3][O].
Молекулы озона образуются в реакции 2, а распадаются в реакциях 3 и 4, поэтому r 2 = r 3 + r 4, или
k 2[O][O2][M] = k 3[O3] + k 4[O3][O].
Атомы кислорода образуются в реакциях 1 и 3 и распадаются в реакциях 2 и 4, поэтому 2 r 1 + r 3 = r 2 + r 4, или
2 k 1[O2] + k 3[O3] = k 2[O][O2][M] + k 4[O3][O].
Складывая эти два уравнения, получаем
k 1[O2] = k 4[O3][O],
откуда
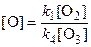 .
.
Вычитая второе уравнение из первого, получаем
k 2[O][O2][M] = k 1[O2] + k 3[O3].
Поскольку по условию k 1 / k 3 = 5,5·10–9 и [O3] / [O2]» 10–5, то 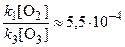 , и величиной k 1[O2] по сравнению с k 3[O3] можно пренебречь. Тогда полученное выражение упрощается:
, и величиной k 1[O2] по сравнению с k 3[O3] можно пренебречь. Тогда полученное выражение упрощается:
k 2[O][O2][M] = k 3[O3].
Подставляя 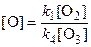 в это выражение, получаем
в это выражение, получаем
k 1 k 2[O2]2[M] = k 3 k 4[O3]2,
откуда
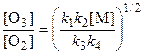 .
.
6. Подставляя численные значения, получаем
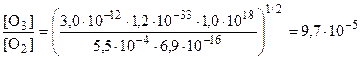 .
.
Полученная величина приблизительно в 10 раз больше экспериментально измеренного значения 10 ppm. Такое различие объясняется тем, что в цикле Чепмена учитывается только «самопроизвольный» распад молекул озона по реакциям 3 и 4. В действительности имеют место и другие механизмы распада озона, например, в присутствии NO, радикалов OH и Cl.
 2015-04-12
2015-04-12 268
268








