1-2. Анализ условия задачи позволяет предположить, что речь идет о соединениях серы: простым веществом Ж желтого цвета может быть сера (S), а отвратительно пахнущим ядовитым газом И с молярной массой 34 г/моль (плотность по аммиаку 2,0, M = 17 · 2 = 34 г/моль) является сероводород (H2S).
Установим формулы солей Д и Е. Заметим, что сумма содержания натрия и серы для соли Е составляет 100 % (т. е. вещество Е – бинарное), а для соли Д до 100 % не хватает 38,08 %, которые, вероятно, приходятся на кислород. Тогда:
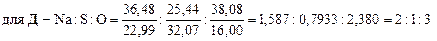
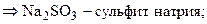
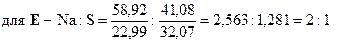
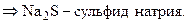
При кипячении раствора сульфита натрия с тонкорастертым порошком серы образуется А – тиосульфат натрия (мольное соотношение реагентов 1: 1):
Na2SO3 + S 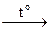 Na2S2O3 (1)
Na2S2O3 (1)
При подкислении водного раствора тиосульфата натрия, вместо тиосерной кислоты (соединение В, H2S2O3) образуется сера и выделяется сернистый газ (З, SO2):
Na2S2O3 + 2HCl ® 2NaCl + H2O + S¯ + SO2 (3)
Нагревание раствора сульфида натрия с тонкорастертым порошком серы приводит к образованию полисульфидов Na2Sn. В зависимости от количества введенной в реакцию с сульфидом серы, удается получить полисульфиды с n = 2–6. Поскольку в условии задачи мольное соотношение сульфида натрия (в расчете на безводную соль) к сере составляет ~1: 3 (на ~0,1 моль (~8 г) Na2S берут ~0,3 моль (~10 г) S), соль Б – тетрасульфид натрия:
Na2S + 3S 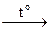 Na2S4. (2)
Na2S4. (2)
При добавлении к водному раствору тетрасульфида натрия избытка соляной кислоты на холоду (~ -10 °C) образуется тетрасульфан (Г) в виде маслянистой желто-оранжевой жидкости. Полисульфан быстро разлагается с образованием серы и сероводорода.
Na2S4 + 2HCl 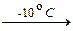 2NaCl + H2S4¯. (4)
2NaCl + H2S4¯. (4)
H2S4 ® 3S¯ + H2S (5)
3. Тиосульфат-ион проявляет восстановительные свойства. Слабые окислители, например, иод, окисляют его до тетратионат-иона (эту реакцию используют в иодометрическом титровании):
2Na2S2O3 + I2 ® Na2S4O6 + 2NaI.
Более сильными окислителями, такими, как хлор, тиосульфат-ион окисляется до сульфат-ионов:
Na2S2O3 + 4Cl2 + 5H2O ® 2NaHSO4 + 8HCl
или
Na2S2O3 + 4Cl2 + 5H2O ® Na2SO4 + H2SO4 + 8HCl.
4. 2FeCl3+ 3Na2S ® 6NaCl + 2FeS¯ + S¯ (6)
2FeCl3 + 3Na2S4 ® 6NaCl + 2FeS2¯ + 8S¯ (7)
SbCl3 + 3Na2Sизб. ® Na3[SbS3] + 3NaCl (8)
SbCl3 + 3Na2S4 изб. ® Na3[SbS4] + 3NaCl + 8S¯ (9)
 2015-04-12
2015-04-12 271
271








