Для хим.реакций равновесным считается состояние, в котором приходит система при постоянных внешних условиях, характеризуемый неизменностью во времени термодинамических параметров и отсутствием в системе потока вещества и теплоты.
аА+вВ→сС+dD
Равновесными называется та пара реакций, сложение которых приводит к нулю. Устойчивое равновесие хим. реакции–это равенство скоростей прямой и обратной реакции. ∆G=0, w1 =w2.
При равновесии не происходит изменение значимых концентраций продуктов в реакции и исходных веществ. Для смещения равновесия в сторону продуктов реакции при установившемся равновесии, необходимо изменить условие процесса. Различают термодинамическое и химическое равновесие системы. Равновесное состояние системы описывается константой равновесия, которая = отношению произведения продуктов реакций к произведению парциальных давлений исходных веществ в соответствующих стехиометрических коэффициентах.
Установить, что реакция равновесная возможно по следующим признакам:
1. отсутствие катализатора для прямой и обратной реакций (газофазные некатал. реакции)
2. наличие прямой и обратной реакций
3. родство каталит. системы для прямой и обратной реакций.
Для установления точки равновесия исп. прямой и обратный метод. При прямом методе загружаются исходные вещества и катализатор, при этом концентрация продуктов должна быть равна 0. реакционная масса выдерживается такое время, после которого состав продуктов не меняется. Возможно это и есть равновесный состав. Для подтверждения используют обратный метод. Берут продукты реакции, в которых отсутствуют исходные вещества, и каталитическую систему, если состав продуктов в прямом и обратном методе идентичен, то этот состав является равновесным для данных условий.
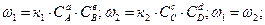
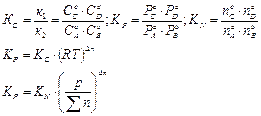
 2015-04-17
2015-04-17 2251
2251
