Для хим.реакций равновесным считается состояние, в котором приходит система при постоянных внешних условиях, характеризуемый неизменностью во времени термодинамических параметров и отсутствием в системе потока вещества и теплоты.
аА+bB↔cC+dD
W1=k1CAa∙CBb-скорость прямой реакции
W2=k2CCc∙CDd-скорость обратной реакции
Из условия равенства, следует W1= W2
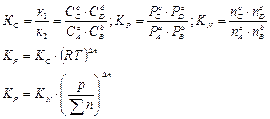
Константа равновесия выражает закон действующих масс:
изменение конц одного из участников реакции вызовет такие изменения конц всех остальных участников, т.о., что константа равновесия сохранит свое числовое значение при постоянной температуре и давлении.
Существуют 2 метода расчета константы равновесия от Т:
1. ∆Н≠f(T)
2. ∆Н=Cp∆T
1) Cp=const
2)для неорг: Cp=a+bT+c’/T2
Для орг: Cp=a+bT+cT2
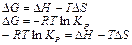
Для смещения равновесия вправо КР↑, если ΔН<0, Т ↓; если ΔН>0, Т ↑
 2015-04-17
2015-04-17 1290
1290

 -
-