| dC dt |
| + |
_ ΔC
*ист — lim,
t ->o Δ t
где Vист - истинная скорость реакции, моль/(л-с); dС, dt - бесконечно малое изменение концентрации и бесконечно малый промежуток времени.
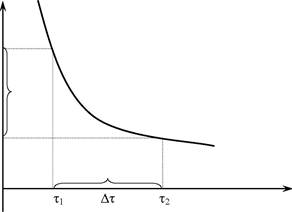
|
| Сi АС С2 |
| Время |
Рис. 6.1. Изменение концентрации исходных веществ во времени
Истинная скорость реакции в данный момент времени определяется как первая производная от концентрации реагирующих веществ по времени. Приблизительно скорость реакции, с-1, можно оценить по времени:
V =
t
Скорость химической реакции зависит от природы и состояния реагирующих веществ, концентрации, температуры реакции, поверхности соприкосновения фаз в гетерогенных системах, катализатора, а также от некоторых других факторов (например, от давления – для газовых реакций, от степени измельчения – для твердых веществ).
Влияние концентраций реагирующих веществ. Чтобы осуществить химическое взаимодействие веществ А и В, их молекулы должны столкнуться. Чем больше столкновений тем быстрее протекает реакция. Число же столкновений, тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ, закон действия масс: при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции.
Математическая запись закона для реакции в общем виде следующая:
 2015-04-01
2015-04-01 280
280







