Фотохимия изучает химические процессы, идущие при воздействии света на вещество. Фотохимические реакции называют фотолизом; они могут совершаться в твердых, жидких и газообразных средах. Фотохимические реакции возникают под влиянием видимого света, инфракрасных и ультрафиолетовых лучей с длинами волн от 100 до 1000 нм. Энергия этих квантов равна от 120 до 1200 кДж/моль или от 1,2 до 12 эВ. Поглощение энергии электромагнитных колебаний усиливает вращательное движение молекул или колебания атомов и атомных групп, составляющих молекулу, и может приводить к возбуждению электронов наружных оболочек атомов и появлению активных частиц. Под действием света протекают многие химические процессы.
В основе фотохимии лежат два закона. Первый закон фотохимии (Гротгуса – Дрепера) гласит, что только поглощаемое средой излучение может произвести ее химическое превращение. Согласно второму закону фотохимии (Эйнштейна – Штарка), каждый поглощенный квант света в первичном акте способен активировать только одну молекулу. На основе второго закона фотохимии количество энергии Е м, поглощаемой одним молем вещества, определяется по уравнению:
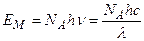 , (4.188)
, (4.188)
где NA – постоянная Авогадро; h – постоянная Планка; n– частота;
с - скорость света; l– длина волны.
Если подставить в уравнение (6.18) численные значения постоянных N A, h и с, то:
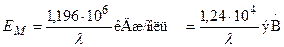 .
.
Большими энергией и химической активностью обладают колебания с меньшей длиной волны. В видимом свете наиболее активными являются фиолетовые лучи с l= 400 нм; для них Е = 297 кДж/моль. Наименее активна красная нить спектра, где l= 750 нм; для нее Е = 159 кДж/моль.
Число молей вещества, которое в единицу времени в единице объема активируется под действием радиации и может участвовать в первичной фотохимической реакции, в соответствии с (4.188) можно рассчитать по уравнению:
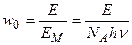 , (4.189)
, (4.189)
где Е – световая энергия, которая поглощается единицей объема системы в единицу времени.
При опытной проверке закона фотохимической эквивалентности Эйнштейна – Штарка иногда обнаруживается расхождение между числом частиц, которые активируются под действием радиации (числом поглощенных квантов), и числом прореагировавших молекул. Сложность общего течения фотохимических реакций зависит от последующих вторичных реакций, идущих без воздействия света, в связи с чем для характеристики фотохимических процессов введено понятие квантового выхода 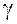 , который равен отношению числа действительно прореагировавших молекул к числу поглощенных квантов. Таким образом, скорость фотохимической реакции определяется по уравнению:
, который равен отношению числа действительно прореагировавших молекул к числу поглощенных квантов. Таким образом, скорость фотохимической реакции определяется по уравнению:
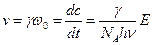 . (4.190)
. (4.190)
Поглощенную энергию Е можно выразить через другие величины. По закону Ламберта – Беера интенсивность I светового потока после прохождения через слой вещества толщиной l равна:
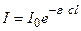 , (4.191)
, (4.191)
где I 0 – начальная интенсивность светового потока радиации; 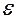 - молярный коэффициент поглощения; с– концентрация вещества, поглощающего свет.
- молярный коэффициент поглощения; с– концентрация вещества, поглощающего свет.
Отсюда поглощенная энергия Е равна:
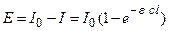 . (4.192)
. (4.192)
Подставляя уравнение (4.192) в (4.190), получим наиболее общее выражение для скорости фотохимической реакции:
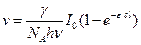 . (4.193)
. (4.193)
Квантовый выход 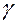 может меняться от 10-3 до 106. При
может меняться от 10-3 до 106. При 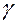 < 1 световая энергия, поглощаемая молекулами, частично расходуется ими на какие-нибудь побочные процессы, например, на соударения с молекулами другого вещества, или она поглощается молекулами других веществ, не участвующих в реакции. Квантовый выход может снижаться также вследствие самопроизвольного протекания обратного процесса. Отклонения в сторону
< 1 световая энергия, поглощаемая молекулами, частично расходуется ими на какие-нибудь побочные процессы, например, на соударения с молекулами другого вещества, или она поглощается молекулами других веществ, не участвующих в реакции. Квантовый выход может снижаться также вследствие самопроизвольного протекания обратного процесса. Отклонения в сторону 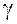 >1 наблюдаются, если реакция является цепной. При этом поглощение молекулой одного кванта приводит к появлению активной частицы, вызывающей развитие цепи, и квантовый выход повышается до очень больших значений.
>1 наблюдаются, если реакция является цепной. При этом поглощение молекулой одного кванта приводит к появлению активной частицы, вызывающей развитие цепи, и квантовый выход повышается до очень больших значений.
Фотохимия имеет важное применение в процессах синтеза в химической промышленности. Основные преимущества фотохимических реакций заключаются в том, что свет может вызывать высокоселективные реакции, приводящие к образованию продуктов, которые было бы трудно или невозможно получить с помощью термических реакций.
Например, если имеется смесь сернистого ангидрида с хлором и углеводородом, то может происходить фотосульфохлорирование. Этот процесс отличается высоким общим квантовым выходом. Продукты реакции – сульфонилхлориды (RSO2Cl) – служат промежуточными продуктами в производстве алкансульфонатов, которые используются в качестве поверхностно-активных соединений и эмульгаторов. Фотохимические процессы лежат в основе производства нейлона.
Фотография, открытая Ньепсом (1826) и впервые осуществленная Дагерром (1839), представляет собой также одно из практических применений фотохимических процессов. В основе фотографического процесса лежит способность галогенидов серебра разлагаться под действием света с выделением металлического серебра.
Большое значение фотохимические процессы имеют в биологии и медицине. УФ-облучение, например, помогает вылечить многие болезни и повысить защитные силы организма.
 2015-04-01
2015-04-01 4050
4050