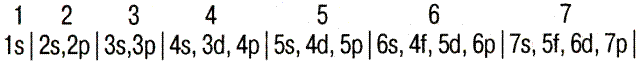 |
| ↑↓ Ячейка (клетка) – орбиталь; Стрелка – электрон; Направление стрелки – направление спина; Свободная клетка – свободная орбиталь. |
| Элемент | Графические электронные формулы | Подробная электронная формула |
| 6С | 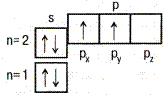 | 1s22s22p 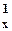 2p 2p 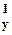 |
| 7N | 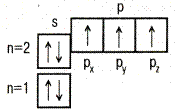 | 1s22s22p 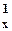 2p 2p 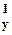 2p 2p 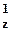 |
| 8O | 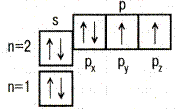 | 1s22s22p 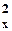 2p 2p 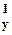 2p 2p 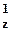 |
| Электронное строение атомов в основном состоянии приведены в Приложении И. |
| Тип элементов (семейство)– зависит от того, какой подуровень заполняется электронами последним. | s - элементы. Заполняется электронами s-подуровень внешнего уровня – первые два элемента каждого периода периодической системы Менделеева. |
| p - элементы. Заполняется p-подуровень внешнего уровня – это последние 6 элементов каждого периода (кроме первого и седьмого периодов). | |
| d - элементы. Заполняются d-подуровень второго снаружи уровня, а на внешнем уровне остается 1 или 2 электрона (у палладия – ноль). К ним относятся элементы вставных декад больших периодов, расположенных между s и p-элементами (переходные элементы). | |
| f - элементы. Заполняется f-подуровень третьего снаружи уровня, а на внешнем уровне остается 2 электрона – это лантаноиды и актиноиды. | |
| Д.И. Менделеевпредложил клеточный вариант таблицы элементов, разбив её на 7 периодов и 8 групп. Период – это горизонтальный ряд элементов, расположенных по мере возрастания заряда ядра. Каждый период начинается типичным металлом и заканчивается типичным неметаллом. Группа–это вертивертикальный ряд элементов представленный элементами аналогами. Элементы аналоги имеют одинаковое электронное строение последнего энергетического уровня, поэтому обладают близкими свойствами. Современная таблица Д.И. Менделеева приведена в Приложении В. |
Периодический закон: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов.
1. Порядковый номер – равен заряду ядра и количеству электронов.
2. Номер периода – количество уровней.
3. Номер группы – максимальная положительная степень окисления.
Периодичность объясняется определенной повторяемостью в заполнении электронных уровней. Чем больше атомный радиус, тем слабее удерживаются внешние электроны, тем больше восстановительная активность атома.
По периоду с увеличением заряда ядра радиус атома уменьшается.
По группе с увеличением заряда ядра радиус атома увеличивается.
Энергия ионизации –энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве от атома образуется катион. График зависимости энергии ионизации от порядкового номера элементаприведенв Приложении Б.
Сродство к электрону – энергия, которая выделяется при присоединении к атому одного электрона. Выражается в электрон-вольтах. При присоединении электронов к атому образуется анион.
| Электроотрицательность – способность атома в соединение притягивать к себе электроны. Самый электроотрицательный элемент – фтор F. По периоду с увеличением заряда ядра электроотрицательность атомов увеличивается. По группе с увеличением заряда ядра – уменьшается. |
| Относительные значения электроотрицательности элементов приведены в Приложении Б. |
 2015-04-01
2015-04-01 2970
2970








