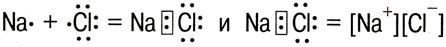Ковалентная связь – химическая связь, осуществляемая за счет образования общей электронной пары.
Соединения с ковалентной связью образуют молекулярные или атомные кристаллические решетки.
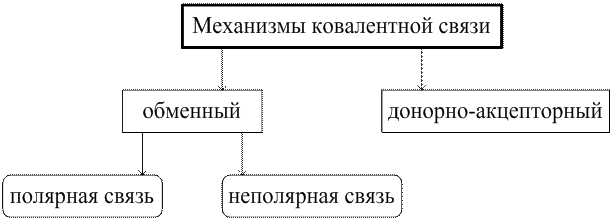
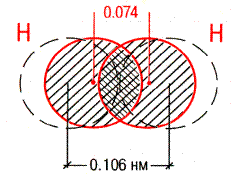
Обменный механизм происходит за счет перекрывания электронных облаков.
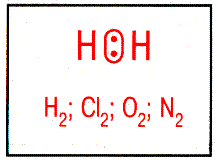
| Неполярная ковалентная связь – электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов. | Полярная ковалентная связь – электронное облако связи смещено к атому с большей относительной электроотрицательностью. |



| Донорно-акцепторный механизм происходит за счёт двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора). Связь называется донорно-акцепторной или координационной. |
Например, ион NH4+ образуется за счёт образования четвёртой связи азотом из аммиака с ионом водорода: 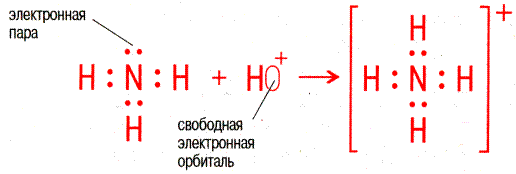 В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями. В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями. |
| Свойства ковалентной связи |
| 1) Длина связи – это межъядерное расстояние. |
| 2) Энергия связи – количество энергии, которое необходимо для разрыва связи; измеряется в кДж/моль. |
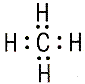
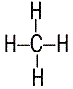
| 3) Насыщаемость – способность атомов образовать ограниченное число ковалентных связей. Например: Н образует 1 связь, С - не более 4 связей. |
| 4) Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). |
| Способы перекрывания электронных облаков |
| σ -связь – перекрывание электронных облаков вдоль оси, соединяющей центры атомов. | π -связь – связь, возникающая между атомами, когда перекрывание электронных облаков происходит по обе стороны от линии, соединяющей ядра обоих атомов. |
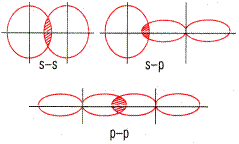 | 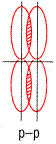 |
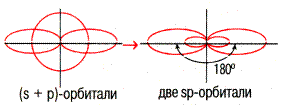
| Гибридизация– выравнивание взаимодействующих орбиталей разных подуровней по форме и энергии. При этом расчетные формы новых орбиталей отличаются от исходных. |
| sp-гибридизация | sp2- гибридизация |
| | 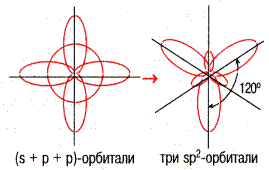 |
| Ионнаяилиэлектровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности. |
 Например: NaCl X(Na) = 1,01 Например: NaCl X(Na) = 1,01  Х(Сl) = 2,85 Х(Сl) = 2,85
Na 1s22s22p63s1 → Na0 – ē → Na+ 1s22s22p6 Cl 1s22s22p63s23p5 → Cl0 + ē → Cl– 1s22s22p63s23p6 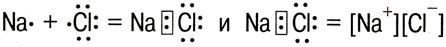 |
| Свойства ионной связи |
| Ненаправленность. Каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению. |
| Ненасыщаемость. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей, способность притягивать по другим направлением остается. |
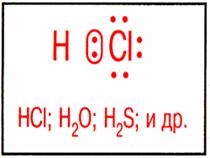
| Полярные молекулы – молекулы при общей нейтральности представляют собой электрический диполь. Например: HCl. | 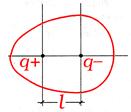 |
гдеμ – электрический момент диполя. Мера полярности связи и молекулы. Выражается в Кл·м (Кулон-метр) от 0 до 3,33 Кл·м; q – эффективный заряд, заряд атома в молекуле; l – расстояние между противоположно заряженными центрами диполя. |
| Поляризуемость – способность атомов, ионов и молекул приобретать дипольный момент (µ) в электрическом поле. |
| Неполярные молекулы – молекулы, содержащие неполярную ковалентную связь – электронное облако симметрично по отношению к ядрам обоих атомов, µ = 0. Например: H2, O2, F2, Cl2 и др. |
| Металлическая связь –связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке. Наличие свободных электронов в решетки обуславливает проводимость электричества и тепла, металлический блеск. Ионы и атомы металла непосредственно не связаны, и их слои могут отдельно перемещаться относительно друг друга, отсюда ковкость и пластичность металлов. | Кристаллическая решетка Na 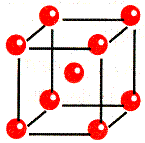 Схема Схема 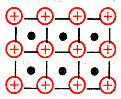 |
| Водородная связь – связь между атомом водорода, соединенным с атомом сильно электроотрицательного элемента, одной молекулы и сильно электроотрицательными (F, O, N) элементами другой молекулы. Возможно образование внутримолекулярной водородной связи. Обозначают точками, так как водородная связь в 15-20 раз слабее ковалентной. Водородная связь оказывает влияние на свойства вещества, так как нужна дополнительная энергия для разрыва водородной связи. | Вода – Н2О 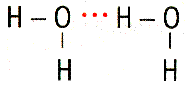 уксусная кислота – СН3СООН уксусная кислота – СН3СООН 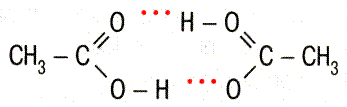 |
| Кристаллическая решетка – пространственный каркас, который возникает, если обозначить все частицы в кристалле в виде точек и соединить эти точки пересекающимися прямыми линиями. Узлы кристаллической решетки – точки, в которых размещены частицы. |
| Типы кристаллических решеток |
| Ионная решетка – состоит из ионов, ее образуют вещества с ионной связью. | Кристаллическая решетка NaCl    |
| Молекулярная решетка – состоит из молекул, соединенных между собой слабыми межмолекулярными силами. | Кристаллическая решетка йода I2  |
| Атомная решетка –в узлах находятся атомы, которые соединены между собой прочной ковалентной связью; вещества тверды, прочны, не растворимы в воде, имеют высокую температуру плавления. | Кристаллическая решетка алмаза С 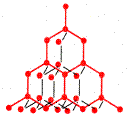 |
| Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. |
| Отрицательное значениестепени окисления имеют атомы, которые приняли электроны от других атомов, то есть в их сторону смещено связующее электронное облако. Например: Na+ | Положительное значениестепени окисления имеют атомы, отдающие свои электроны другим атомам, то есть связующее электронное облако оттянуто от них. Например: Cl– | Нулевое значениестепени окисления имеют атомы в молекулах простых веществ, электронное облако в равноймере принадлежит обоим атомам. Например: Na, Cl2, O2, H2 |
Алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю: 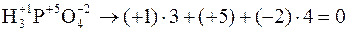 ; а в сложном ионе – заряду иона: ; а в сложном ионе – заряду иона: 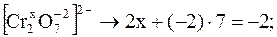 x= +6. x= +6. |
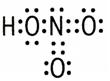
| Валентность– способность атомов элемента образовывать химические связи. Количественной мерой является число связей, образованных данным атомом с другими атомами или атомными группами. Валентность химических элементов принято определять числом ковалентных связей, которыми данный атом соединен с другими атомами. Валентность элементов определяется также числом электронных пар, образующих химическую связь. |
Например: азот – N 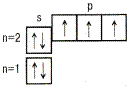 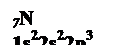 |
| Валентность N = 3 |
| Азот – N2 | 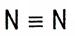 |
| Гидразин – N2H4 | 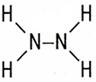 |
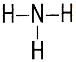
| Аммиак – NH3 | 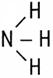 |
| Валентность N = 4 |
Ион аммония – NH 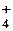 | 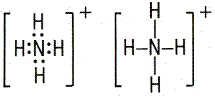 |
| Валентность N = 5 |
| Азотная кислота – HNO3 | 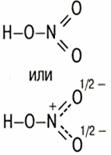 |
| | | | |







 В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями.
В данном случае азот является донором, а водород – акцептором. Ион, образованный за счет координационной связи, называется комплексным ионом, а соединения, содержащие подобные ионы, – комплексными соединениями. 
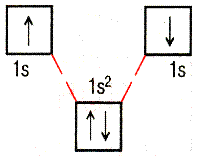 2) С помощью кватовых ячеек.
2) С помощью кватовых ячеек. 



 Например: NaCl X(Na) = 1,01
Например: NaCl X(Na) = 1,01 
 Схема
Схема 
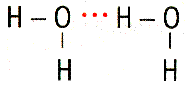 уксусная кислота – СН3СООН
уксусная кислота – СН3СООН 




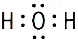
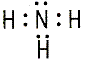
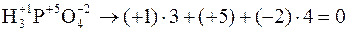 ; а в сложном ионе – заряду иона:
; а в сложном ионе – заряду иона: 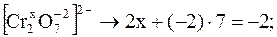 x= +6.
x= +6. 
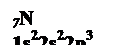
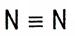


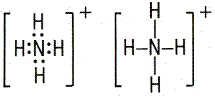

 2015-04-01
2015-04-01 771
771


 Х(Сl) = 2,85
Х(Сl) = 2,85