| Оксид углерода (II):С=О: | Оксид углерода (VI) O=С=О |
| I. Получение. 1) В промышленности СО2 +С = 2СО 2) В лаборатории HCOOH=H2O+CO↑ II. Физические свойства:газ без цвета и запаха, очень ядовитый, так как соединяется с гемоглобином крови, плохо растворим в воде. III. Химические свойства: CO – восстановитель. 1) CO + CuO = Cu + CO2 2) 2CO + O2 = 2CO2 ΔH = -572 кДж – горит синим пламенем | I. Получение.
1) В промышленности
CaСО3 = CaO + СО2↑
2) В лаборатории
CaСО3+2HCl=CaCl2+CO2↑+ H2O
II. Физические свойства:
бесцветный газ, тяжелее воздуха, не поддерживает дыхание; растворим в воде, при t = –76˚С – сухой лед.
III. Химические свойства:
1) CO2 – кислый оксид.
а) CO2 + H2O 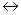 H2CO3
б) CO2 + 2NaOH = Na2CO3 + H2O
2) CO2 – окислитель
а) CO2 + С = 2СО
б) CO2 + 2Mg = 2MgO + C
IV. Применение: в производстве соды, сахара, газированных напитков; в жидком виде – в огнетушителях; сухой лед – для хранения продуктов. H2CO3
б) CO2 + 2NaOH = Na2CO3 + H2O
2) CO2 – окислитель
а) CO2 + С = 2СО
б) CO2 + 2Mg = 2MgO + C
IV. Применение: в производстве соды, сахара, газированных напитков; в жидком виде – в огнетушителях; сухой лед – для хранения продуктов.
|
| Угольная кислота H2CO3 | |
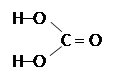 Существует только в растворе, в свободном виде не устойчив, слабый электролит.
H2CO3 = CO2↑ + 2H2О – при нагревании
Диссоциация:
H2CO3
Существует только в растворе, в свободном виде не устойчив, слабый электролит.
H2CO3 = CO2↑ + 2H2О – при нагревании
Диссоциация:
H2CO3 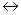 H+ + H+ + 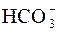
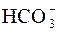  H+ + H+ + 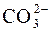
|
| Соли угольной кислоты | |
| Карбонаты | Гидрокарбонаты |
Карбонаты щелочных металлов и 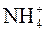 растворимы в воде; щелочноземельных металлов – мало растворимы.
CaCO3 растворимы в воде; щелочноземельных металлов – мало растворимы.
CaCO3 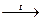 CaO + CO2↑ CaO + CO2↑
| Гидрокарбонаты щелочных, щелочноземельных металлов и 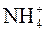 растворимы в воде.
Получение:
CaCO3+ СО2 + Н2О = Ca(НCO3)2
Ca(НCO3)2 растворимы в воде.
Получение:
CaCO3+ СО2 + Н2О = Ca(НCO3)2
Ca(НCO3)2 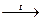 CaCO3+ СО2↑ + Н2О CaCO3+ СО2↑ + Н2О
|
| Na2CO3 – карбонат натрия: белый порошок; используется в производстве стекла, мыла, бумаги, моющих средств. K2CO3– поташ: белый порошок; используется в производстве жидкого мыла, оптического стекла пигментов. СaCO3 – мел, мрамор, известняк; используется в строительстве. | NaНCO3 – гидрокарбонат натрия или питьевая сода: белый порошок, плохо растворяется в воде; используется в пищевой промышленности, медицине. |
| Качественная реакция на карбонат-ион: 1) CaCO3+2НСl = СО2↑ + CaCl2 + Н2О – «вскипание» за счет выделения СО2, далее 2) пропускаем СО2 через Ca(OH)2: Ca(OH)2 + СО2 = CaCO3↓ + Н2О – раствор мутнеет 3) при избытке СО2: CaCO3+СО2+Н2О=Ca(НCO3)2 – помутнение исчезает. |
 2015-04-01
2015-04-01 454
454








