Рис.1 Лицевая панель термостата
1-индикатор аварийного превышения температуры; 2-индикатор включения нагревателя; 3-тумблер включения режима «нагрев»; 4- индикаторы температуры; 5-переключатель индицируемой температуры; 6,7 - элементы, задающие температуру.
Автоклав служит для стерилизации посуды, питательных сред и других материалов насыщенным паром под давлением выше атмосферного. Автоклавы бывают вертикальные или горизонтальные, но принципиальная схема их устройства одинакова (рис.2).
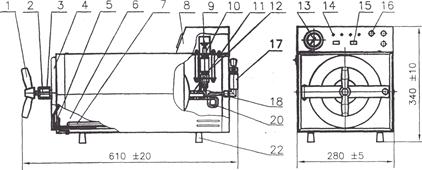 |
Рис. 2. Стерилизатор паровой горизонтальный настольный ГК – 10 –1- «ТЗМОИ»
1 – винтовой затвор; 2 - фиксатор; 3 - траверса; 4 - дверь; 5 - прокладка; 6 – камера стерилизационная; 7 – электронагреватель трубчатый; 8 –пульт управления; 9- регулировочный винт; 10 - микровыключатель; 11, 18, 20 – трубопровод; 12 – сильфон; 13 – монометр; 14 – лампа сигнальная; 15 – кнопка; 16 – предохранитель; 17 – клапан предохранительный; 22 - ножка
Сушильный шкаф (рис.3) с терморегулятором предназначен для сушки и стерилизации лабораторной посуды, высушивания различных материалов до постоянной массы. Сушильный шкаф изготавливают из термостойких материалов (металла и асбеста) и рассчитывают на диапазон температур в рабочей камере от 40 до 2000С. Длительность разогревания до предельной температуры – около 1,5 ч. Внутри шкаф оборудован полками из дырчатых листов металла, на которых размещают посуду или высушиваемый материал.
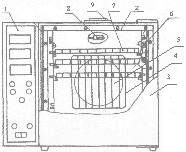 |
Рис. 3. Сушильный шкаф:
1- блок управления; 2- корпус; 3 – дверца; 4 - теплоизолятор; 5 – крыльчатка; 6 - электронагреватели трубчатые; 7 – кассеты; 8 – датчик температуры; 9 – заслонка шиберная.
Холодильник бытовой используют для хранения при температуре около +40С музейных и рабочих культур микроорганизмов, питательных сред, некоторых реактивов и растворов, исследуемого материала, в том числе пищевых продуктов.
Посуда. Для микробиологических исследований используют стеклянную или пластмассовую (одноразовую) посуду: чашки Петри (диаметром 10см., высотой 1,5 см.) применяют для выделения чистых культур, количественного учета микроорганизмов, анализа микрофлоры на плотных питательных средах и других исследований; колбы Виноградского, плоские бутыли-матрацы, качалочные колбы – для выращивания аэробных микроорганизмов; пробирки и колбы с поплавками – для изучения процессов брожения.
Кроме специальной микробиологической посуды используют обычную химическую посуду: колбы плоскодонные, конические эрленмейера, круглодонные, мерные (25, 50, 100, 200 мл.); пипетки градуированные (1, 2, 5, 10 мл.), пипетки Мора (1,2,5,10,20,25,50,100 мл), пастеровские пипетки с оттянутым капилляром, пробирки биологические (без ранта) 18х2; 18х1,5; 15х1,5 см; бюретки, капельницы, воронки, мензурки, цилиндры, бюксы, склянки. В настоящее время все большее распространение получает использование одноразовых чашек Петри и дозиметрических механических пипеток со съемными наконечниками.
Инвентарь. В микробиологической практике применяют петли, иглы (рис.4), пинцеты, ножницы, металлические цилиндры для пипеток, проволочные или металлические с отверстиями; корзины для стерилизации пробирок, пластмассовые или металлические штативы для пробирок и др.

Рис. 4. Игла (а) и петля для пересевов микроорганизмов:
б, в – петля выполнена неправильно; г – петля выполнена правильно
Биологический микроскоп. Биологический микроскоп представляет собой оптический прибор, предназначенный для получения сильно увеличенных изображений малых организмов и структур растительных и животных тканей, невидимых невооруженных глазом. Микроскоп раскрывает тайны микромира, делает видимыми мельчайшие частицы, Свойство микроскопа изображать объект минимальных размеров называется его разрешающей способностью. Она определяет то наименьшее расстояние, на котором два рядом расположенных элемента структуры могут еще быть видимы раздельно.
Наименьшие частицы, видимые в современные световые биологические микроскопы, имеют размеры больше 1/3 длины волны света (не менее 0,0002 мм).
Разрешающая способность нормального глаза человека составляет 0,2 мм. Чтобы довести размеры частиц, равные 0,0002 мм, до размеров, видимых глазом человека, необходимо увеличение в 100 раз. Такое увеличение, называемое полезным, в современных световых биологических микроскопах доведено до 2000 раз. Микроскопы, увеличивающие более 2000 раз, дают расплывчатое искаженное изображение и на практике не применяются.
Устройство микроскопа. Микроскоп состоит из двух частей: механической и оптической (рис. 5).
Механическая часть, или штатив. В штативе различают следующие детали.
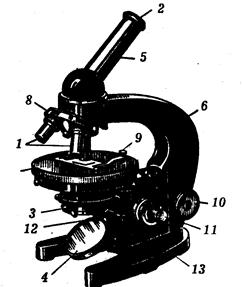
Рис. 5. Микроскоп биологический МБИ-1:
1 - объективы; 2 - окуляр; 3 - конденсор; 4 - зеркало; 5 - тубус; б - тубусодержатель; 7 - предметный столик; 8 - револьвер; 9 - клемма; 10 - макрометрический винт; 11 - микрометрический винт; 12 - винт конденсора; 13 – ножка или башмак подковообразной формы
Предметный столик для препарата может быть подвижным и неподвижным. Подвижные столики делают круглыми или крестообразными. При вращении боковых винтов круглый столик начинает медленно двигаться. Вместе с ним передвигается препарат, который закрепляют двумя зажимами - клеммами. На крестообразном столике препарат может передвигаться в двух перпендикулярных направлениях.
Тубусодержателъ (ручка, колонка) служит для переноса микроскопа.
Тубус (труба) предназначен для установки окуляра и объектива. Он передвигается вверх и вниз при помощи двух винтов. При полном обороте микровинта тубус передвигается на 0,1 мм. Если винт перестает вращаться в одну сторону, то ход пройден до конца и его следует вращать в обратную сторону. Вращая винт по часовой стрелке, тубус опускают, а против часовой стрелки - поднимают.
Макрометрический винт (кремальера, зубчатка) используется для грубой установки фокуса оптической системы на препарат.
Микрометрический винт предназначен для точной установки фокуса оптической системы на препарат.
Револьвер, или вращающаяся насадка, расположен на нижнем конце тубуса. В нем имеются 2-3-4 гнезда с нарезкой для объективов. При повороте револьвера вокруг оси под тубус подводится один из объективов. Для установки объектива на оптическую ось на револьвере имеется соответствующий желобок, в который входит ступица, закрепляющая объектив на оптической оси, о чем свидетельствует щелчок.
Детали штатива должны быть хорошо пригнаны друг к другу и легко вращаться без приложения силы.
Оптическая часть микроскопа состоит из объектива, окуляра и осветительного аппарата.
Объектив представляет собой систему оптических линз (до 10 шт.), который должен обладать необходимой увеличительной способностью и определенной глубиной фокуса. Увеличительная способность зависит от фокусного расстояния линзы, т. е. чем короче фокусное расстояние, тем больше увеличительная способность микроскопа. Объектив дает действительное увеличенное обратное изображение, раскрывая детали строения рассматриваемого предмета. Крайняя к препарату фронтальная линза легко повреждается при небрежной работе. Различают сухие (или воздушные) и иммерсионные (или масляно-погруженные) объективы. При пользовании сухим объективоммежду фронтальной линзой и препаратом находится слой воздуха. Увеличение на таких объективах соответственно обозначают целыми числами (8, 20, 40, 60) или условными цифрами и буквами (1, 3, 8 и от А до F), которые расшифровывают по прилагаемой к микроскопу таблице. Кроме того, увеличение обозначают фокусными расстояниями в миллиметрах (16, 8, 4).
Иммерсионным называется объектив, в котором между фронтальной линзой и препаратом помещают каплю кедрового масла (кедроля). Оптический коэффициент преломления кедроля близок к коэффициенту преломления стекла (1,52). Благодаря этому сохраняются и проходят через фронтальную линзу объектива лучи, которые вследствие преломления (на границе стекло препарата - воздух) рассеялись и отклонились. При этом уменьшилась бы освещенность поля зрения. Увеличения иммерсионных объективов обозначают целыми числами (90, 100, 101, 110), а в некоторых системах микроскопов - дробями (1/12; 1/18), соответствующими фокусным расстояниям в английских дюймах или в миллиметрах (3; 2; 1,5).
Окуляр вкладывают в верхний конец тубуса. Он состоит из двух линз в оправе, между которыми помещена диафрагма. Линзу, обращенную к глазу, называют глазной, к препарату - собирающей. Боковые лучи диафрагма задерживает, а близкие к оптической оси пропускает, что дает более контрастное изображение. На окулярах нанесены даваемые ими увеличение или условные цифровые обозначения (5, 7, 10, 15, I, II, IV). Окуляр увеличивает изображение предмета, раскрытое и увеличенное объективом. Новых деталей окуляр не дает.
Осветительный аппарат состоит из конденсора, диафрагмы и зеркала, помещенных под столиком микроскопа.
Конденсор представляет собой систему оптических линз, которая собирает лучи света и направляет их на препарат; он равномерно освещает поле зрения. Передвигается конденсор по вертикали при помощи винта и может быть совсем выдвинут в сторону от центральной оптической линии микроскопа. При опускании конденсора ноле зрения микроскопа затемняется, при поднятии - освещается.
Ирисовая диафрагма помещена под конденсором. Она служит для регулирования силы света. Окрашенные объекты рекомендуется рассматривать с более открытой диафрагмой, чем неокрашенные. При пользовании иммерсионным объективом и искусственным освещением диафрагму открывают.
Зеркало отражает падающие на него лучи света и направляет их в конденсор для освещения препарата. Одна сторона зеркала плоская, другая - вогнутая. Для дневного источника света, лучи которого параллельны, при больших увеличениях применяют плоское зеркало. Вогнутое зеркало используют при искусственном свете и расходящихся лучах или для малых увеличении при дневном свете. Для работы с конденсором обычно пользуются плоским зеркалом.
Микроскоп дает мнимое обратное увеличенное изображение предмета. Общее увеличение микроскопа равно произведению увеличения объектива и окуляра. Различают малое, среднее и большое увеличение. Окуляры с сухими объективами дают малое и среднее увеличение (от 50 до 600-700 раз), а с иммерсионными объективами — до 2000—3000 раз. Отечественный микроскоп М-9 увеличивает предмет в пределах от 56 до 1350 раз.
Правила работы с микроскопом. Для освещения микроскопа следует пользоваться искусственным освещением.
1. Освещение поля зрения искусственным источником света. Повернуть зеркало вогнутой стороной. Вращая рукой револьвер, поставить на центральную оптическую ось малое увеличение (объектив 8*). Подвести объектив под тубус. Щелчок говорит о том, что объектив закреплен на оптической оси. Открыть диафрагму осветителя, слегка поднять конденсор, снять с микроскопа окуляр и, смотря через тубус в объектив, установить зеркало так, чтобы источник света был] виден на середине фронтальной линзы объектива. Вставить окуляр в тубус. Смотря в окуляр, уловить зеркалом лучшую освещенность поля зрения; если поле зрения излишне освещено, слегка прикрыть диафрагму или опустить конденсор.
2. Установка препарата на фокус. Поставить на столик микроскопа препарат и зажать его клеммами. Наблюдая сбоку, опустить объектив при помощи микрометрического винта почти до препарата. Смотря в микроскоп, медленно поднимать тубус до появления отчетливых контуров препарата. Уточнить фокус вращением микрометрического винта не более чем на один-два полных оборота в ту или другую сторону. При равномерном и полном освещении рассмотреть несколько полей зрения препарата, передвигая столик боковыми винтами. Повернуть револьвер, подвести под тубус среднее увеличение (объектив 40, 60), установив его на оптической оси (должен быт щелчок). Наблюдая сбоку, опустить объектив близко к препарату, но не касаясь его. Глядя в окуляр, медленно поднимать тубус до появления контуров препарата. Уточняя видимость, микровинтом, установить фокус и рассмотреть препарат. Нанести на препарат небольшую каплю кедроля. Повернуть револьвер и установить (должен быть щелчок) на центральной оптической оси иммерсионный объектив (90). Наблюдая сбоку, погрузить иммерсионный объектив в каплю масла, почти соприкасаясь линзой с предметным стеклом препарата. Смотря в микроскоп, осторожно и медленно поднимать тубус, вращая макрометрический винт на себя (не отрывая объектива от кедроля), до появления контуров препарата. Уточнить фокус микрометрическим винтом. Рассмотреть в препарате несколько полей зрения, передвигая столик боковыми винтами. Сравнить изображения препарата при пользовании сухим объективом и иммерсионным. Вычислить увеличение микроскопа для данного объектива и окуляра. После окончания работы микроскоп следует обтереть тряпкой, а объективы (иммерсионные) - мягкой тряпкой, слегка смоченной в спирте. Микроскоп убрать на место, где он хранится. Предметные стекла с отработанными препаратами опустить в банку с дезинфицирующим раствором.
Вопросы
1. Какое назначение имеет лаборатория микробиологии пищевых продуктов?
2. Какие требования предъявляются к помещению лаборатории микробиологии?
3. Каковы правила работы в лаборатории микробиологии?
4.Для чего используется термостат, автоклав, сушильный шкаф?
5. Для каких целей предназначен биологический микроскоп?
6. Из каких частей состоит микроскоп?
7. Какое назначение макро- и микрометрического винтов? Как ими пользоваться?
8. Что такое сухие и иммерсионные объективы?
9. Зачем используют кедровое масло при работе с иммерсионным объективом?
10. Как регулировать степень освещенности препарата?
Питательные среды для культивирования микроорганизмов.
Методы работы с микроорганизмами.
Лабораторно-практическое занятие № 2
Состав и назначение питательных сред. В состав питательных сред должны входить органогенные элементы (углерод, водород, кислород, азот), зольные макроэлементы (фосфор, сера, калий, кальций, магний, железо), некоторые микроэлементы (марганец, медь натрий, хлор, цинк, бор, молибден и др.). Перечисленные элементы должны находиться в форме легкоусваиваемых микроорганизмами соединений. Углерод наиболее легко потребляется микроорганизмами гетеротрофами в форме глюкозы. Кроме глюкозы гетеротрофы усваивают другие сахара, спирты, органические кислоты и другим соединения. Источником азота могут быть белковые вещества, пептоны, аминокислоты, соли аммония, нитраты. Остальные элементы вводятся в виде солей. Источником ростовых веществ чаще являются дрожжевые экстракты или дрожжевые автолизаты, реже растворы витаминов, аминокислот, пуриновых и пирамидиновых оснований. Питательные среды должны быть сбалансированы по составу концентрации растворенных веществ, иметь оптимальные влажность, вязкость, реакцию среды (рН), окислительно-восстановительный потенциал.
По составу питательные среды делятся на естественные (натуральные) и искусственные (синтетические).
Натуральные среды состоят из продуктов животного и растительного происхождения, имеют сложный и непостоянный состав. Их используют для выращивания микроорганизмов, накопления биомассы, хранения чистых культур, диагностических целей, но они мало пригодны для изучения физиологии обмена веществ. Наиболее часто используют следующие натуральные среды: ломтики картофеля, моркови, молоко, мясо-пептонный бульон (агар), пивное сусло и сусло агар, дрожжевую воду, капустную среду и др.
Синтетические среды имеют в составе определенные химически органические и неорганические соединения в точно указанных концентрациях (аминокислоты, сахара, витамины, минеральные соли). По набору компонентов синтетические среды могут быть сложными (среды для выращивания молочнокислых бактерий) и простыми (среды для автотрофных микроорганизмов). Синтетические среды используют для исследования обмена веществ, выявления закономерностей роста или биосинтеза какого-либо метаболита и т. д. На практике для выращивания грибов применяют синтетическую среду Чапека, дрожжей — среду Ридера и др.
По назначению различают среды: универсальные, элективные и дифференциально-диагностические. К универсальным (основным или стандартным) относятся среды, благоприятные для выращивания многих видов микроорганизмов: мясо-пептонный бульон, неохмеленное пивное сусло и др. Элективные, или избирательные, среды обеспечивают развитие только определенных микроорганизмов или группы родственных видов и не пригодны для роста других. Элективные среды применяют для выделения микроорганизмов из природных мост обитания или производственных субстратов, получения накопительных культур (среда Кесслера) и др.
Дифференциально-диагностические, или индикаторные, среды используют для дифференцирования видов микроорганизмов и идентификации чистых культур на основе изучения их биохимических свойств.
По консистенции питательные среды бывают жидкими, плотными и сыпучими. Жидкие среды применяют для накопления биомассы или продуктов обмена, поддерживания клеток в активном состоянии, хранения, исследования физиолого-биохимических свойств микроорганизмов, плотные — для анализа микрофлоры различных объектов, выделения чистых культур микроорганизмов, получения изолированных колоний, изучения их культуральных особенностей, количественного учета клеток, хранения чистых культур в музеях, пересылки их на заводы и т. д., сыпучие (отруби, разваренное пшено, свекловичный жом, жмыхи, почва) - для хранения некоторых видов микроорганизмов и их спор, приготовления маточного и посевного материала.
Методы работы с микроорганизмами. Порядок проведения посева и пересева микроорганизмов. Для выделения микроорганизмов из производственных и природных субстратов, поддержания в активном состоянии чистых культур, приготовления рабочих культур с целью передачи в производство и т.п. в лабораторной практике пользуются методами посева и пересева. Посевом (или инокуляцией) называется внесение части исследуемого материала в стерильную питательную среду культуры микроорганизма, пересевом - перенос части выращенной культуры микроорганизмов на другую свежую стерильную среду.
При посеве и пересеве необходимо соблюдать следующие приемы (рис. 6).
1. В левую руку берут две пробирки: одну со стерильной средой, другую - с культурой и держат в наклонном положении. В правой руке большим и указательным пальцами держат бактериальную петлю и стерилизуют в пламени горелки.
2. Вынимают ватные пробки из обеих пробирок, прижимают их к ладони мизинцем и безымянным пальцами правой руки и обжигают края пробирок. Следят за тем, чтобы пробирки не касались посторонних предметов.
3. Петлю вводят в пробирку с пересеваемой микробной культурой. Осторожно, не касаясь стенок, отбирают каплю жидкой культуры. Если производят пересев с косого слоя агара, то для охлаждения петли вначале следует прикоснуться к поверхности агара, где нет культуры, а затем взять небольшое количество микробной массы со скошенной плотной среды.
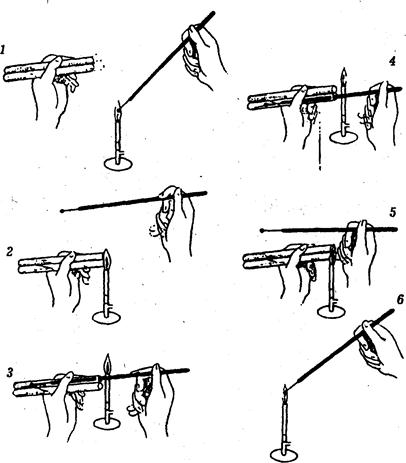
Рис. 6. Пересев культуры микроорганизма:
1 - обжиг петли; 2 - обжиг краев пробирок; 3 - набор культуры; 4 - посев культуры; 5 - обжиг краев пробирок; 6 - обжиг петли
4. Вводят петлю с материалом в пробирку со стерильной жидкой средой, стараясь не задевать стеной пробирки. При посеве на скошенные питательные среды петлю с клетками микроорганизмов опускают почти до дна, где скапливается небольшое количество конденсационной воды. Слегка касаясь петлей поверхности среды, но не разрыхляя ее, проводят от дна вверх штрих.
5. Петлю вынимают, обжигают края пробирок и внутренние концы пробок, пробирки закрывают.
6. Петлю вновь прокаливают в пламени горелки.
7. На пробирке чернилами или карандашом по стеклу (или наклеивают этикетку) делают надпись, в которой указывают название культуры и дату посева. Засеянные пробирки помещают в термостат для выращивания при постоянной температуре.
Описанные операции проводят около пламени горелки (но не в пламени), по возможности быстро, чтобы не загрязнить культуры посторонними микроорганизмами. Нельзя делать резких движений, ходить, кашлять и т.п. около работающего с чистой культурой, так как движение воздуха увеличивает опасность случайного заражения культуры и среды. Поэтому посевы и пересевы микроорганизмов лучше проводить в боксе.
Посев в жидкую среду можно производить петлей или пипеткой (пастеровской или градуированной). Обе пробирки держат в слегка циклонном положении, чтобы не замочить ватные пробки. Петлю с микробным материалом опускают непосредственно в стерильную среду и ополаскивают.
При внесении клеток, взятых петлей из плотной среды, материал тщательно растирают по стенке пробирки у верхнего края жидкой среды, все время смывая его средой.
Посев на плотные среды. Посевы петлей на скошенном агаре производят зигзагообразным штрихом, свободно скользя петлей по поверхности плотной среды от одного края пробирки (чашки Петри) к другому; или прямой чертой, для этого петлей проводят прямую линию снизу вверх посредине поверхности питательной среды; или сплошным посевом, растирая материал осторожными круговыми движениями по всей поверхности среды.
Посев в чашки Петри производят следующим образом: плотную питательную среду в пробирках или колбах расплавляют на кипящей водяной бане, охлаждают до 48-50оС и, соблюдая правила стерильности, разливают ровным слоем толщиной 35 мм в стерильные чашки. Застывшую среду можно слегка подсушить в термостате. Посев делают стеклянным шпателем Дригальского (рис. 7) или петлей в виде параллельных или зигзагообразных штрихов (метод истощающего посева).
В столбик агаризованной среды посев производят уколом (рис. 8).
Засеянные и надписанные пробирки, колбы или чашки Петри помещают в термостат для выращивания.
Методы получения накопительных культур. Накопительными называют культуры, в которых преобладают представители близких видов или даже одного вида микроорганизмов. Из накопительных культур выделяют чистые культуры. Для получения накопительных культур создают условия, которые обеспечивают преимущественное развитие интересующих исследователя микроорганизмов. Для этого прежде всего используют специфические избирательные среды, которые наиболее полно удовлетворяют физиологические потребности в источниках питания определенных групп микроорганизмов.
Важные факторы, влияющие на получение накопительной культуры: реакция среды (рН), температура, наличие или отсутствие кислорода, устойчивость к антибиотикам и некоторым другим соединениям.
 |
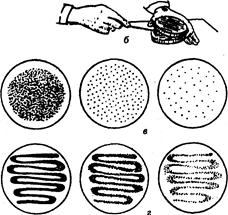 |
Рис. 7. Посев микроорганизмов на поверхность плотной среды в чашках Петри:
а - шпатель Дригальского; б - положение чашки и руки при посеве шпателем: в - рост микроорганизмов после рассева шпателем; г - рост микроорганизмов после рассева петлей
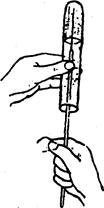
Рис. 8. Посев уколом
Так, увеличивая кислотность среды, устраняют возможность развития бактерий и создают благоприятные условия для размножения дрожжей и мицелиальных грибов. Получение накопительных культур термофильных организмов осуществляют при температуре 45-65°С, реже при 70~75°С. Внесение в среду определенных концентраций пенициллина способствует развитию грамотрицательных бактерий или дрожжей. Неомицин или пенициллин совместно со стрептомицином подавляют бактериальную микрофлору и создают условия для преимущественного развития дрожжей. Нистатин, наоборот, препятствует жизнедеятельности дрожжей, не окапывая влияния на бактерии. Для получения накопительных культур аэробных микроорганизмов питательную среду разливают тонким слоем (1,5—2 см) в колбы и культивируют на качалках. Для обогащения анаэробными микроорганизмами среды разливают доверху в высокие пробирки или флакончики с притертыми пробками.
В результате повторных пересевов на одну и ту же элективную среду и создания благоприятных условий для видов культура постепенно обогащается микроорганизмами с желаемыми свойствами и обедняется сопутствующими формами.
Методы выделения чистых культур. Изучение морфологических, культуральных, физиологических особенностей микроорганизмов, использование микроорганизмов в промышленности возможно только при наличии чистых культур. Чистой культурой называют потомство, полученное из одной клетки. Существует несколько методов выделения чистых культур. Все методы основаны на выделении из микробной популяции одной единственной клетки.
Выделение чистой культуры из одной колонии. Этот метод ввёл в микробиологическую практику Кох. Плотные питательные среды расплавляют на кипящей водяной бане, охлаждают до 48-50 0С и разливают в чашки Петри. Для этого сосуд со средой берут в правую руку, держат в наклонном положении, вынимают ватную пробку. Обжигают горловину сосуда в пламени горелки и, приоткрыв большим и указательным пальцами левой руки крышку чашки, быстро выливают расплавленную среду (15-20 мл). Крышку тотчас же закрывают, чашки оставляют на столе до полного застывания среды.
При поверхностном способе выделения аэробных микроорганизмов каплю накопительной культуры или её разведения наносят петлёй или пипеткой в центр застывшей среды, чуть приоткрыв крышку чашки Петри. Нанесённую каплю осторожно распределяют стерильным стеклянным шпателем Дригальского по все поверхности среды в чашке, затем этим же шпателем с остатками материала протирают поверхность среды последовательно во второй, затем в третьей, реже в четвёртой чашке Петри. При этом крышка каждой чашки должна быть открыта настолько, чтобы в щель мог пройти только шпатель. По окончании распределения накопительной культуры шпатель помещают в дезинфицирующий раствор. Таким же образом можно производить выделение чистых культур из производственный дрожжей, бражки, молока, воды, пива, вина, кваса, теста, почвы, смывов сырья и т.д., предварительно подготовив разведения в стерильной воде или физиологическом растворе. После засева чашки надписывают, переворачивают вверх дном, чтобы конденсационная вода, образовавшаяся под крышкой при застывании среды, не капал вниз и не размывала изолированные колонии. Чашки выдерживают 2-7 суток в термостате (скорость роста различных микробов неодинакова) и ежедневно просматривают. Каждая клетка остаётся на том месте, куда она попала в момент распределения. Здесь клетки находят благоприятные условия для своего развития, начинают размножаться и образуют колонии, т.е. огромное количество клеток одного вида. Выросшие колонии просматривают сначала невооружённым глазом, затем с помощью лупы или под микроскопом.
Микроорганизмы, относящиеся к факультативным анаэробам, чаще выделяют методом глубинного посева. Для этого плотные питательные среды разливают по 15-20 мл в пробирки и стерилизуют. Непосредственно перед выделением среду в пробирке расплавляют, охлаждают до 48-50 0С и стерильной петлёй вносят каплю накопительной культуры. Пробирку закрывают ватной пробкой, содержимое перемешивают, затем 2-4 капли смеси переносят во вторую пробирку. 5-6 капель из второй пробирки пересевают в третью. Таком образом получают ряд разведений посевного материала, который после перемешивания путём вращения пробирок между ладонями в стерильных условиях выливают в чашки Петри. Среду с микроорганизмами распределяют ровным слоем по дну чашки и ставят на горизонтальную поверхность для застывания. При высеве глубинным способом часть колоний вырастает внутри агара. Их вырезают стерильным скальпелем или стерильной петлёй и переносят в жидкую среду, благоприятную для развития выделяемых видов.
Для выделения анаэробных микроорганизмов по методу Коха необходимо ограничить доступ кислорода к культуре. С этой целью поверхность глубинного посева в чашке Петри заливают стерильной смесью парафина и вазелина (1:1). Можно использовать специальные стерильные трубки длиной 20-30 см, диаметром 0,2-0,7 см, сделанные по типу пипеток Пастера. После заполнения трубки смесью разведения накопительной культуры и расплавленной и охлаждённой питательной среды трубку запаивают с двух сторон (со стороны капилляра и в месте перетяжки). Можно оставлять посевной материал, тщательно перемешанный с агаризованной, хорошо осветлённой питательной средой, непосредственно в обычной пробирке. Ватную пробку заменяют резиновой или заливают поверхность агара смесью парафина и вазелинового масла. Чтобы извлечь выросшие колонии анаэробных микроорганизмов, пробирки или трубки слегка нагревают, быстро вращая над пламенем горелки. Агар, прилегающий к стенкам, расплавляется, и столбик выскальзывает в подготовленную стерильную чашку Петри. Столбик агара разрезают стерильным ланцетом, колонии извлекают стерильной петлёй или стерильной капиллярной трубкой и переносят в жидкую среду.
Методы определения отдельных групп микроорганизмов.
Метод 1.Определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ). Настоящий метод распространяется на пищевые продукты, содержащие в 1 г 300 и более или в 1 мл 30 и более микроорганизмов и устанавливает порядок определения жизнеспособных клеток мезофильных аэробных и факультативно-анаэробных микроорганизмов.
Метод основан на высеве определённого количества продукта или его разведений в агаризованную питательную среду, культивировании посевов в аэробных условиях при 300С в течение 72 ч, подсчёте всех выросших видимых колоний мезофильных аэробных и факультативно-анаэробных микроорганизмов и пересчёте их количества на 1 г (мл) продукта.
Масса (объём) навески, предназначенной для приготовления исходного разведения, должна составлять не менее 10 г (мл), а предназначенной для непосредственного высева в питательные среды – не менее 1 г (мл).
Из навески продукта готовят исходное и ряд десятикратных разведений. По 1 мл продукта и/или его разведений высевают одновременно в две стерильные чашки Петри. В каждую чашку Петри, содержащую инокулум, добавляют не позднее чем через 15 мин расплавленную и охлаждённую до 450С плотную питательную среду. Среду немедленно и равномерно перемешивают с посевным материалом и оставляют для застывания в горизонтальном положении.
После застывания агаризованной среды посевы инкубируют, поставив чашки дном вверх, при 300С в течение 72 ч.
Результаты оценивают по каждой пробе отдельно. На чашках, где выросло от 30 до 300 колоний, подсчитывают все колонии, суммируют и находят среднее арифметическое. Полученное среднее арифметическое число колоний округляют:
- если меньше 100, его округляют до ближайшего числа, делящегося на 5;
- если больше 100 и его последняя цифра 5, округляют до ближайшего числа, делящегося на 20;
- если больше 100 и его последняя цифра не 5, округляют до ближайшего числа, делящегося на 10.
Количество микроорганизмов в 1 г (мл) продукта вычисляют умножением округлённого среднего арифметического числа колоний на разведение навески и делением на количество вносимого посевного материала (масса, объём) в чашку. Например, округлённое среднее арифметическое число колоний с двух чашек, засеянных по 1 мл из 10 разведений, равнялось 220. Общее количество микроорганизмов в 1 г продукта будет равно
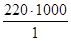 =220000
=220000
Общее количество микроорганизмов записывают в виде числа: (от 1 до 9,9) ×10. Например, 220000 клеток в 1 г записывают как 2,2×105 КОЕ/г.
Метод 2. Определение бактерий группы кишечной палочки (БГКП) посевом в жидкие среды. Настоящий метод распространяется на пищевые продукты, не содержащие в 1 г (мл) или содержащие в 1 г (мл) менее 1000 колиформных бактерий, и устанавливает порядок определения наиболее вероятного числа (НВЧ) жизнеспособных клеток колиформных бактерий. Колиформные бактерии – это грамотрицательные палочки, ферментирующие лактозу при 30-370С в течение 24-48 ч с образованием кислоты и газа.
Метод основан на высеве определённого количества продукта и/или его разведений в ряд пробирок с жидкой селективно-диагностической средой с лактозой, культивировании в аэробных условиях при 300С в течение 24-48 ч, учёте положительных пробирок и определении наиболее вероятного числа в 1 г (мл) продукта колиформных бактерий, ферментирующих лактозу с образованием газа и кислоты.
Масса (объём) навески для приготовления исходного разведения должна составлять не менее 10 г (мл), а для непосредственного высева в питательные среды – не менее 1 г (мл). Из навески продукта готовят исходное и ряд десятикратных разведений до такой степени, чтобы окончательное разведение давало отрицательный результат.
По 1 мл разведений и (если необходимо) по 1 г неразведённого продукта высевают параллельно в три пробирки, содержащие по 9 мл одной из жидких сред (накопительных сред) с трубками Дархема (поплавками). Традиционной накопительной средой является среда Кесслера. Если требуется выявление бактерий в определённой массе продукта, то это количество высевают непосредственно в жидкую питательную среду.
Посевы инкубируют при 300С в течение 48 ч. Пробирки просматривают через 24 ч и регистрируют те из них, в которых отмечен рост микроорганизмов (помутнение среды, образование любого количества газа, изменение цвета и другие признаки). Окончательный учёт проводят через 48 ч: отмечают пробирки, где имеет место рост микроорганизмов, и используют их для дальнейшего исследования.
Из каждой пробирки с признаками роста микроорганизмов делают пересевы петлёй на плотные диагностические среды. При определении БГКП пользуются преимущественно средой Эндо. Одну чашку среды можно использовать для высева одновременно трёх пробирок, разделив дно чашки на секторы. Посевы на плотных средах делают таким образом, чтобы получить рост изолированных колоний. Посевы термостатируют при 370С в течение 24 ч.
Через 24 ч выдержки посевов на плотной среде их просматривают и отмечают рост колоний, характерных для бактерий: на среде Эндо – плоские или слегка выпуклые или с валиком, красные с различной интенсивностью окраски, с металлическим или без металлического блеска. Из подозрительных колоний делают фиксированные препараты, окрашивают по Граму и микроскопируют. При обнаружении грамотрицательных палочек считают, что в продукте присутствуют БГКП. Результат записывают как «обнаружены (не обнаружены) БГКП в анализируемой массе продукта».
Метод 3. Определение количества бактерий Staphylococcus aureu. Метод основан на высеве определённого количества продукта или его разведений в ряд пробирок с жидкой элективной средой, культивировании посевов при 370С в течение 48 ч, учёте положительных пробирок и определении наиболее вероятного числа в 1 г (мл) продукта грамположительных кокков, способных коагулировать плазму крови кролика.
Масса (объём) навески для приготовления исходного разведения должна составлять не менее 10 г (мл), а для непосредственного высева – не менее 1 г (мл).
Из навески продукта готовят исходное и ряд последовательных разведений до такой степени, чтобы последнее разведение давало отрицательный результат.
По 1 мл разведений и (или), если это необходимо, неразведённого продукта высевают параллельно в три пробирки, содержащие по 9 мл среды выделения.
Посевы инкубируют при 370С в течение 48 ч.
Через 24 ч посевы просматривают и отмечают пробирки, в которых имеется рост микроорганизмов (помутнение среды, изменение цвета среды, появление осадка, плёнки и т.д.) Окончательный учёт производят через 48 ч.
Из каждой пробирки с ростом микроорганизмов делают пересевы на подтверждающую среду. Одну чашку можно использовать для высева одновременно из трёх пробирок, разделив дно чашки на секторы. Посевы на поверхность сред делают штрихами, чтобы получить рост изолированных колоний. Посевы инкубируют при 370С в течение 24-48 ч.
Через 24 ч предварительно и через 48 окончательно проводят изучение характерных колоний Staphylococcus aureu: на среде желточно (молочно) – солевом агаре – крупные, плоские, блестящие, окружённые радужной зоной; на желточном агаре – непрозрачные, окрашенные от белого до оранжевого цвета, 2-4 мм в диаметре. Делают фиксированный препарат, окрашивают по Граму и микроскопируют. Стафилококки окрашиваются по Граму положительно, имеют шарообразную форму и располагаются скоплениями. При выявлении бактерий Staphylococcus aureu в определённой массе (объёме) прродукта результаты записывают как «обнаружены (не обнаружены)бактерии Staphylococcus aureu в анализируемой массе продукта ».
Метод 4. Определение количества плесневых грибов и дрожжей. Метод основан на высеве определённого количества продукта или его разведений в селективную агаризованную среду, культивировании посевов в аэробных условиях при 24 0С в течение 5 дней, подсчёте всех видимых колоний плесневых грибов и дрожжей, типичных по макро- и (или) микроскопической морфологии и пересчёте их количества на 1 г (мл) продукта.
Масса (объём) навески для приготовления исходного разведения должна составлять не менее 10 г (мл), а для непосредственного высева в питательные среды – не менее 1 г (мл). Из навески продуктов готовят исходное и ряд десятикратных разведений.
По 1 мл продукта или его разведений высевают параллельно в две чашки Петри. В каждую чашку Петри, содержащую продукт или его разведение, добавляют не позднее чем через 15 мин 14-15 мл расплавленной и охлаждённой до 450С аагаризованной среды. Посевы тщательно перемешивают вращательным движением чашки Петри и оставляют на столе в горизонтальном положении для застывания. После застывания агаризованной среды посевы для предотвращения высыхания агара оставляют крышками вверх и термостатируют при температуре 240С в течение 5 дней. Через три дня термостатирования проводят предварительный учёт типичных колоний, а через 5 дней – окончательный. Через 5 дней просматривают посевы и отбирают чашки, на которых выросло от 5 до 50 изолированные колонии плесневых грибов или от 15 до 150 дрожжей.
Развитие плесневых грибов на поверхности плотной среды характеризуется появлением пушистого паутинообразного или ватообразного роста. Дрожжи на поверхности среды образуют белые или матовые колонии с ровными краями и выраженным центром. Под агаром –это мелкие или средних размеров белые колонии; в глубине агара – чечевицеобразные колонии чаще красного цвета с выступающим иногда над поверхностью агара ростом.
Для подтверждения роста дрожжей проводят их изучение. Для этого готовят фиксированные препараты и окрашивают метиленовой синью в течение 3-5 мин, а затем промывают водопроводной водой, подсушивают и микроскопируют. Метиленовая синь окрашивает фон препарата значительно слабее, дрожжевые клетки. Дрожжевые клетки значительно крупнее бактериальных, диаметр их достигает 8-14 мкм. Форма их разнообразна – яйцевидная, эллиптическая, цилиндрическая, лимоновидная, шаровидная. Под микроскопом часто видно почкование у дрожжей в виде бугорков на поверхности клетки.
Результаты оценивают по каждой пробе отдельно. Уточняют число плесневых грибов на чашках, где выросло от 5 до 50 колоний, и (или) дрожжей от 15 до 150 колоний и пересчитывают на 1 г (мл) продукта. Для этого находят среднее арифметическое числа колоний плесневых грибов и (или) дрожжей, округляют его согласно методу 1 при определении большого количества бактерий, умножают на степень разведения и делят на количество посевного материала (масса, объём), внесённого в чашку.
Количество плесневых грибов и дрожжей записывают в виде числа: (от1 до 99)×10n. Например, 150 клеток в 1 г записывают как 1,5×10 КОЕ/г.
При применении метода посева продукта непосредственно в жидкую среду посевы термостатируют при температуре 24оС в течение 72 ч, отмечают, есть или нет роста плесневых грибов и (или) дрожжей.
Результаты записывают как «обнаружены (не обнаружены) плесневые грибы и (или) дрожжи в анализируемой массе продукта».
 2015-04-01
2015-04-01 1872
1872







